предметів
реферат
Введення бортезомібу суттєво покращило виживання при ММ як у трансплантаційних, так і в нетрансплантаційних умовах. Коли в дослідженні VISTA до мельфалан-преднізону додавали бортезоміб, який не потребував корекції функції нирок, RI не був небажаною функцією в експериментальній групі. 18 У дослідженні HOVON-65/GMMG-HD4 прогностичний ефект RI досліджували у двох групах лікування, включаючи аутоімплантанти на основі мелфалану. Одна рука отримувала індукцію бортезомібу, адріаміцину та дексаметазону (PAD) до та після лікування бортезомібом після аутологічної трансплантації стовбурових клітин, тоді як інша рука отримувала індукцію вінкристину, адріаміцину та дексаметазону (VAD) та підтримку талідоміду. Хоча частота ниркової відповіді була однаковою після PAD та VAD, частота відповіді MM, включаючи повну відповідь, була вищою як при PAD, так і при загальній виживаності (OS) та виживанні без прогресування захворювання (PFS). Насправді ОС та ПФС не залежали від ІР у групі ПАД і нагадували результати пацієнтів без РІ, які отримували ВАД. Спостереження подібних реакцій нирок на ВАД та ПАД та все ж гірше виживання при ВАД показало несприятливу особливість ММ, пов’язану з РІ, яку можна було подолати включенням бортезомібу до ПАД.
При вивченні клінічних результатів після подальших досліджень загальної терапії (ТТ) спостерігався значний прогрес у виживаності під час переходу від ТТ1 до ТТ2 і ТТ3. 19 Включення бортезомібу у фази індукції, консолідації та підтримання TT3 призвело до різкого поліпшення клінічних результатів, але було обмежено 85% пацієнтів із низьким ризиком профілювання експресії генів плазматичних клітин (GEP). 15% пацієнтів із захворюваннями високого ризику (GEP70> 0,66) продовжували зазнавати невдач, незважаючи на додавання бортезомібу та імуномодулюючих засобів. Ми також виявили, що не було прогресу в переході від TT2 до TT3 для RI. Зараз ми досліджуємо, чи відсутність поліпшення клінічних результатів обмежувалась пацієнтами, які не покращились порівняно з вихідним рівнем ІР.
Матеріали і методи
Дані клінічних результатів включали ОС та ПФС. Ми також вивчили час до прогресування (TTP). Для цілей цього аналізу ми розрахували розрахункову швидкість клубочкової фільтрації (eGFR) для всіх пацієнтів, які застосовують оригінальну модифікацію дієти у пацієнтів із захворюваннями нирок 25, як рекомендує Міжнародна робоча група з мієломи. 5 Вищезазначені клінічні кінцеві точки досліджували між чотирма класами нирок (RC): RC1 (eGFR
90 мл/хв/1,73 м 2), RC2 (eGFR 60–89 мл/хв/1,73 м 2), RC3 (eGFR 30–59 мл/хв/1,73 м2) та RC4 (eGFR 26 TTP аналізували шляхом оцінки кумулятивного частота даного результату 27 та порівняння між групами RC (1–3 проти 4) за допомогою тесту log-rank. Регресійні моделі відносної небезпеки були використані для виявлення асоціації між групами RC (1–3 проти 4) та результатами виживання. 28 Багатовимірні моделі були отримані з використанням послідовного вибору моделі з вхідним рівнем P 0, 1, де змінна залишалася в моделі, якщо вона була значущою на 0, 05. Індикатор протоколу TT3 був включений у багатовимірний аналіз для обліку використання бортезомібу . у TT3a та TT3b порівняно зі схемами TT2 За допомогою помилкової швидкості відкриття q = 0,05 було виявлено 46 значущих генних зондів, які відрізняли ці підмножини RI.
результат
Вихідні характеристики пацієнтів, включаючи розподіл RC, були в значній мірі подібними в схемах лікування. TT3 включав більшу частку пацієнтів з високим рівнем В2М> 5,5 мг/л, гіпоальбумінемією 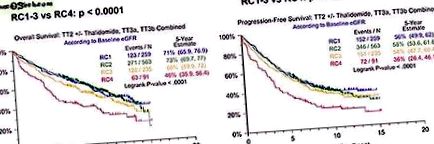
Клінічні результати із загальними протоколами терапії (TT2, TT3) за базовим класом eGFR (RC1-4). a ) загальне виживання; ( b ) прогресування - вільне виживання.
Повнорозмірне зображення
Загальна виживаність та без прогресування за загальним протоколом терапії (TT2 - Thal, TT2 + Thal, TT3a та TT3b разом) для базових класів RC1-3 та RC4. a ) загальна виживаність для RC1-3; b ) загальна виживаність для RC4; ( c ) виживання без прогресування для RC1-3; a ( d ) прогресія - вільне виживання для RC4.
Повнорозмірне зображення
Стіл в натуральну величину
Подальші аналізи були зосереджені на когорті низького ризику GEP70, щоб зосередитись на популяції, для якої RC4 працює гірше, ніж RC1-3. Щоб висвітлити події, пов’язані з ММ, ми дослідили TTP у визначеному GEP70 ММ із низьким ризиком (рис. 3). Значно крутіший початок прогресування RC4 порівняно з пацієнтами з RC1–3 свідчить про те, що різниця у виживаності пов’язана з ММ. Це спостереження змусило нас дослідити, чи різниця у вихідних характеристиках залежала від RC у пацієнтів із GEP70 із низьким ризиком розвитку ММ. Хоча загальна частота СА була однаковою серед груп RC (41% з RC4 проти 31% з RC1–3; P = 0,07), типи CA з високим ризиком, особливо CA13 та/або гіподиплоїдія, були надмірно представлені в RC4 (40% проти 19% у РК
Час до прогресування мієломи низького ризику, визначеної GEP70, згідно з RC. a ) за окремими квартилями РК; ( b ) RC4 проти RC1-3.
Повнорозмірне зображення
Стіл в натуральну величину
Потім ми дослідили підписи GEP між визначеними GEP70 ММ з низьким ризиком щодо RC4 та RC
Загальна виживаність, виживання без прогресування та час до прогресування при мієломі низького ризику, визначеному GEP70, відповідно до базової та трансплантації РК. a ) Загальна виживаність краща з RC1-3 в обидва моменти часу; b ) виживання без прогресування захворювання краще при RC1-3 в обидва моменти часу; c ) час течії найбільш дрібно з RC1-3 в обидва моменти часу.
Повнорозмірне зображення
Стіл в натуральну величину
обговорення
Ми підтвердили несприятливі прогностичні наслідки RI, виміряні значеннями eGFR
- Серозний менінгіт - наслідки
- Серія про причини безпліддя Дисфункція яєчників та сперміограма - Gyncare - Центр безпліддя
- Регенерація та підтримка належної функції печінки, жовчного міхура та підшлункової залози
- Ниркова коліка під час вагітності симптоми та лікування ниркової кольки під час вагітності відповідно
- Ниркова коліка - причини, дієта
