- Предмети
- Резюме
- Вступ
- Методи
- Хімічні продукти
- Тварини
- Аналіз аортальної судинної реактивності
- Аналіз мезентеріальної судинної реактивності
- Культура клітин
- Вестерн-блот
- Гістологія
- Статистика
- Результати
- Вплив PVAT на реактивність аорти
- Вплив PVAT на реактивність брижової артерії
- HFD зменшує активність eNOS
- Реконструкція аорти та PVAT у щурів у HFD
- Експресія AMPK та mTOR в аортах щурів у HFD
- Вплив PVAT на експресію AMPK/mTOR в культивованому VSMC
- Обговорення
Предмети
- Стільникова сигналізація
- Жири
- Ожиріння
- Судинні захворювання
Резюме
Методи
Хімічні продукти
Фенілефрин (PE), ацетилхолін (ACh) та нітрогліцерин (NTG) були придбані у Sigma-Aldrich (Taufkirchen, Німеччина).
Тварини
Самці щурів Wistar віком від 6 до 8 тижнів були отримані з річки Чарльз (Сульцфельд, Німеччина). Щурів утримували в режимі 12/12 год вдень/вночі, і всім тваринам давали їжу та воду ad libitum. Місцевий Комітет з догляду та використання тварин затвердив усі процедури догляду та використання тварин. Дослідження відповідає Посібнику з догляду та використання лабораторних тварин, опублікованому Національним інститутом охорони здоров’я США (Публікація NIH № 85-23, переглянута 1996 р.). Тварини отримували стандартну харчову дієту (контрольна група, n = 18) або HFD (група HFD, n = 18) протягом 6 місяців.
Аналіз аортальної судинної реактивності
Аналіз мезентеріальної судинної реактивності
Культура клітин
VSMC отримували з грудної аорти щурів та культивували з використанням методу тканинного експлантату, як описано раніше нашою групою. 27 периваскулярних адипоцитів було отримано з жирової тканини періаорти і культивовано з використанням методу тканинного експлантату, як описано вище. 28 кокультур VSMC/адипоцитів було встановлено у присутності або відсутності 10 мкМ сполуки C, інгібітора AMPK (Calbiochem, Сан-Дієго, Каліфорнія, США), як це було раніше описано на протилежних сторонах пластикових вкладишів з пористого поліетилентерефталату, які мали ефективна площа культури 0,3 см 2, розмір пор 0,4 мкм і щільність пор 1 × 108 на см 2 (Бектон Дікінсон, Франклін-Лейкс, Нью-Джерсі, США).
Вестерн-блот
Гістологія
Товщину аортальної туніки визначали за встановленими методиками. 29 Тканину аорти фіксували у 10% сольовому розчині, забуференному формальдегідом/фосфатом, і вкладали у парафін. Після планових гістологічних процедур поперечні зрізи, проксимальніші від першої міжреберної артерії, фарбували Вікторією Блю та Понсо S і досліджували зі збільшенням × 200. Зображення отримували цифровою камерою за допомогою мікроскопа Nikon TE2000 (Nikon Corporation, Токіо, Японія). Середовище оболонки було визначено як область між внутрішньою та зовнішньою еластичними пластинками, яку вимірювали в чотирьох ортогональних точках артеріальних зрізів протягом трьох послідовних аортальних кілець на тварину за допомогою програмного забезпечення для візуалізації NIS-Elements 3.0 (Nikon Corporation).
Розмір периаортальних адипоцитів вимірювали, як описано раніше. З шести щурів було зібрано 30 периаортальних жирових тканин, зафіксованих 10% забуференним формаліном, вкладених у парафін та забарвлених гематоксиліном та еозином. Зображення були зроблені за допомогою мікроскопа Nikon TE2000 (Nikon Corporation), а площа загальної кількості 100 адипоцитів, відібраних у кожної щури, була визначена за допомогою програмного забезпечення для обробки зображень NIS-Elements 3.0 (Nikon Corporation).
Статистика
Дані є середніми ± сем. Напівмаксимальна ефективна концентрація агоніста (EC 50) та максимальна відповідь (E max) були розраховані за індивідуальними кривими концентрація-відповідь агоніста за допомогою GraphPad Prism 3.0 (Сан-Дієго, Каліфорнія, США). Статистичні відмінності середніх значень оцінювали за допомогою t-критерію Стьюдента або одностороннього дисперсійного аналізу з використанням багаторазових порівняльних тестів Bonferroni post hoc, за необхідності. Двосторонні значення Р нижче 0,05 вважалися статистично значущими.
Результати
Вплив PVAT на реактивність аорти
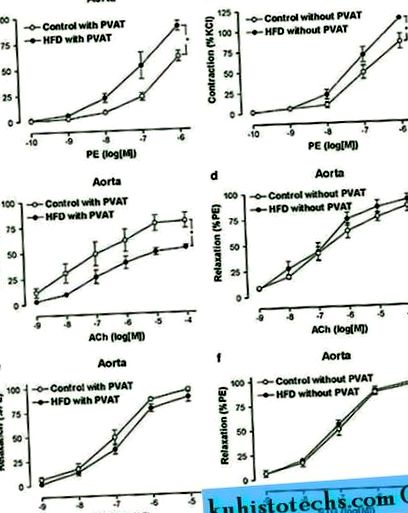
Порівняно з щурами, які годувались їжею, маса тіла та маса жирової тканини помітно збільшувались у щурів на HFD протягом 6 місяців (табл. 1). Проте систолічний артеріальний тиск у манжеті хвоста не відрізнявся між двома групами (127 ± 4 мм рт. Ст. При СНЧ проти 123 ± 5 мм рт. Ст. При дієті Чоу, Р> 0,05). Індукована РЕ скорочувальна реакція аортальних кілець помітно зростала у щурів, що годувались HFD, особливо у присутності PVAT (рис. 1а та b) (табл. 2). Крім того, залежність від ендотелію релаксації була значно знижена у щурів з HFD порівняно з щурами на харчовій дієті лише у присутності PVAT (рис. 1c та d) (таблиця 2). Однак на незалежне розслаблення ендотелію не впливало ні наявність, ні відсутність PVAT у щурів, ні з дієтою Чоу, ні з DCA (рис. 1e та f) (табл. 2).
Повний розмір таблиці
Вплив PVAT на реактивність аорти. ПІ-індукована усадка ( до, b ) та розслаблення, спричинене ACh або NTG ( c - F ) оцінювали на свіжоізольованих аортальних кільцях з ПВАТ або без нього від щурів, які знаходились на контрольній дієті з високим вмістом жиру (HFD). Результати представляють середнє значення ± sem від 6 до 8 кілець від 6 до 8 щурів на групу. * P
Вплив PVAT на реактивність брижової артерії. ПЕ-індукована усадка ( до, b ) та розслаблення, викликане ACh- ( c, d ) або NTG ( і, F ) оцінювали у свіжоізольованих брижових артеріальних кільцях за наявності або відсутності їх периаортальної жирової тканини. Результати є середніми ± sem 5–10 кілець 5–10 щурів на групу; * P
Експресія ENOS і фосфорилювання в аорті. Загальний вміст eNOS та p-eNOS Ser1777 у тканині аорти у щурів, що годували (контролем) або HFD, визначали методом Вестерн-блот. Гістограми показують відносне фосфорилювання, нормалізоване до контрольної групи. Результати представляють середнє значення ± сім з 4–8 незалежних експериментів 4–8 щурів. ** P 2, відповідно, P
Реконструкція аорти та PVAT у щурів у HFD. ( до ) Зображення показують поперечні зрізи аорт, забруднених синім кольором Вікторія та Понсо S від кожної групи щурів. Ліва панель, група управління; права панель, група HFD. Смужка шкали позначає 100 мкм; збільшення, × 200. ( b ) На графіку показано кількісне визначення товщини середовища оболонки. Результати становлять середнє значення ± sem (n = 3 щури на групу). ** P ** P 31 Експресія AMPK та фосфорилювання в аортах щурів на HFD були значно зменшені порівняно з такими, що перебувають на харчовій дієті (рис. 5а). Як показано в репрезентативних смугах, рівні загального та фосфорильованого mTOR значно зросли з подачею HFD (Малюнок 5b). Однак відношення фосфорильованого mTOR до загального mTOR не змінилось (рис. 5b). Крім того, експресія білка PI3K та Akt та фосфорилювання в аорті були однаковими у двох групах (малюнки 5c та d).
Експресія та фосфорилювання білків AMPK, mTOR, PI3K та Akt у тканині аорти. AMPK/p-AMPK Thr172 ( до ), mTOR/p-mTOR Ser2448 ( b ), PI3K/p-PI3K ( c ) та Akt/p-Akt ( d ) в чау- (контрольній) або тканині аорти, що харчується HFD. Щурів виявляли вестерн-блот. Гістограми показують відносне фосфорилювання, нормалізоване до контрольної групи. Результати є середніми ± sem для 4-8 незалежних експериментів 4-8 щурів. ** Р
Незважаючи на те, що у спонтанно гіпертонічних щурів повідомлялося про зменшення ефекту периваскулярного жиру на мезентеріальних артеріолах, 5 нечисленні дослідження вивчали роль PVAT у ожирінні. Це дослідження вперше показує, що наявність PVAT погіршує релаксацію як провідної артерії, так і малих артеріол у індукованих HFD щурів із ожирінням. Крім того, у ожирілих щурів, що страждають на HFD, у PVAT є більші адипоцити та більш товста оболонка аорти. З огляду на ці нові висновки, ми вирішили дослідити його основні механізми.
AMPK є членом сімейства метаболіточутливих протеїнкіназ, присутніх у всіх еукаріотів, і, як вважають, регулює проліферацію клітин у відповідь на енергетичний статус або доступність поживних речовин. mTOR, еволюційно збережена серин/треонінкіназа, інтегрує поживні та мітогенні сигнали для регулювання росту та поділу клітин за допомогою трансляції/синтезу білка. Активація AMPK пригнічує передачу сигналів mTOR і підвищує активність комплексу TSC1-TSC2. 38 Ці результати свідчать про те, що активація AMPK пригнічує активність mTOR для обмеження синтезу білка. NO відіграє вирішальну роль в модуляції судинної релаксації, а активність ферменту, відповідального за вироблення NO, eNOS, регулюється низкою протеїнкіназ, включаючи AMPK. 21 AMPK необхідний для адипонектину, тромбіну та індукованого гістаміном фосфорилювання NOS та подальшої ендотеліальної продукції NO. двадцять один
Поточні результати показують, що у аортах щурів із ожирінням, спричинених HFD, рівні AMPK та p-eNOS знижуються, тоді як експресія mTOR збільшується. Крім того, інкубація культивованого VSMC з PVAT зменшує експресію AMPK і збільшує експресію mTOR. Наші результати підтверджують уявлення про те, що аномальний сигнальний шлях AMPK/mTOR може бути відповідальним за індуковану HFD судинну дисфункцію та ремоделювання у ожирілих щурів. Крім того, інгібуючий ефект сполуки С на індуковане культурою збільшення фосфорилювання mTOR додатково підтверджує, що mTOR регулюється PVAT через активацію AMPK.
Патофізіологічний механізм, за допомогою якого PVAT може опосередковувати судинну дисфункцію та реконструкцію, до кінця не вивчений. Потенційним посередником пропонується посилене вироблення активних форм кисню, які беруть участь у механізмах, що сприяють дисфункції ендотелію та призводять до ремоделювання судин. Повідомлялося, що PVAT індукує прозапальний стан у мишей із ожирінням, індукованих HFD. 19 Запальна клітинна інфільтрація в периваскулярній тканині і, як наслідок, міграція запальних факторів до судинної стінки також можуть бути можливими механізмами, що призводять до судинної дисфункції та ремоделювання.
- Тіло груші або тіло яблука, що визначає, що в одних областях ми накопичуємо більше жиру, ніж в інших
- Низька концентрація міді, пов’язана з жирними жирними клітинами
- Підвищений жир у животі під час вагітності може віщувати діабет під час вагітності
- Будьте обережні з харчуванням, тіло потребує жиру Кур’єр
- Автомобіль; Унікальні змішані єдиноборства (ММА) Навчання P; Втрата жиру - MSN Health and