предметів
реферат
Кістка постійно оновлюється шляхом заміни старої кістки на нову кістку шляхом ремоделювання кістки, процесу трансформації, що складається із взаємодії та балансу між кістками, що розсмоктують кістки (остеокласти), та кісткоутворюючими клітинами (остеобласти) Потенційний дисбаланс між остеокластами та остеобластами відіграє вирішальну роль у патогенезі остеопорозу.
Дефіцит естрогену у жінок в постменопаузі стимулює формування остеокластів, що призводить до розвитку постменопаузального остеопорозу 2, 3. За оцінками, дефіцит естрогену остеопороз вражає 40% жінок у віці старше 50 років. Серед наявних в даний час антиостеопоротичних препаратів показано, що замісна терапія естрогеном у постменопаузі має найсильніший захисний ефект проти остеопорозу у жінок. На жаль, використання гормональних добавок у жінок у постменопаузі було обмеженим через можливий підвищений ризик раку молочної залози та ендометрія при тривалому застосуванні 5. Отже, розуміння клітинних та молекулярних механізмів, що обумовлюють зміни активності клітин, пов’язаних з ремоделювання кісток, може визначити потенційні терапевтичні мішені для остеопорозу та інших патологій, пов’язаних з кісткою.
Остеокласти отримують з недиференційованих клітин у лінії моноцити-макрофаги. Зокрема, вони одночасно стимулюються двома цитокінами: стимулюючим фактором колонії макрофагів (M-CSF) та ядерним фактором - активатором рецептора ліганду каппа В (RANKL). M-CSF має важливе значення для виживання та поширення попередників остеокластів, і RANKL відіграє ключову роль у диференціації та активації остеокластів 6. Індукована RANKL активація RANK на клітинах-попередниках остеокластів призводить до вербування фактора 6, пов’язаного з фактором некрозу пухлини (TNF), активуючи тим самим декілька сигнальних молекул, таких як NF-κB та мітоген-активована протеїнкіназа (MAPK). на ранній стадії диференціації остеокластів 7. Цей сигнальний каскад призводить до активації основних факторів транскрипції, таких як активований Т-клітинний ядерний фактор c1 (NFATc1) та c-fos, член транскрипційних факторів 8, 9 активатора білка 1 (AP-1) 8, 9, 10 .
Матеріали і методи
Реактиви та антитіла
Мінімальний рівень ефірного середовища альфа (α-MEM) та бичача сировина плоду (FBS) були придбані у компанії Life Technologies (Gibco BRL, Гранд-Айленд, Нью-Йорк, США). Рекомбінантну мишу M-CSF придбали у Miltenyi Biotec (Gladbach, Німеччина). Рекомбінантний мишачий sRANKL був отриманий від Prospec Biotec (Ness-Ziona, Ізраїль). SB 203580, SP 600125 та PD 98059 були придбані у Enzo Life Sciences (AG, Швейцарія). 17β-естроген (Е2) отримували від Sigma-Aldrich (Сент-Луїс, Міссурі, США). Антагоніст рецепторів естрогену (ER) ICI 182, 780 був придбаний у Tocris Bioscience (Брістоль, Великобританія). Антитіла до PRMT1, ASYM24, регулярної або фосфо-форми р65, р38, кінази позаклітинної регуляції сигналу (ERK) та N-кінцевої кінази c-Jun (JNK) були придбані у Cell Signaling Technology (Danvers, MA, USA). актин та катепсин K були придбані у компанії Santa Cruz Biotechnology (Санта-Крус, Каліфорнія, США).
Остеокластична диференціація та фарбування TRAP
Для генерування остеокластів клітини кісткового мозку миші виділяли із стегнових кісток мишей віком 6-8 тижнів (Samtako, Gyunggi-Do, Корея). Після лізису еритроцитів решта клітини кісткового мозку інкубували при температурі 37 ° C протягом 3 днів у 5% CO 2 в α-MEM з додаванням 10% FBS та 1% пеніциліну/стрептоміцину у присутності M-CSF (30 нг/мл). Макрофаги, отримані з кісткового мозку (BMDM), отримували шляхом видалення плаваючих клітин. Прикріплені клітини (BMDM) використовувались як попередники остеокластів. BMDM культивували у присутності M-CSF (30 нг/мл) та RANKL (100 нг/мл) протягом ще 3 днів. Формування остеокластів визначали фарбуванням стійкої до тартрату кислою фосфатазою (TRAP). Через 3 дні клітини фіксували фіксуючим розчином протягом 30 с, а фарбування TRAP проводили за допомогою комерційного набору (Sigma, MO, США) згідно з інструкціями виробника. Кількість TRAP-позитивних багатоядерних клітин (MNC, що містить більше трьох ядер) підраховували за допомогою світлового мікроскопа.
Експерименти на тваринах
Миші з гаплонедостатністю PRMT1 (PRMT1 +/-) на фоні C57BL/6 люб’язно надані Dr. Seung-Hoi Koo (кафедра наук про життя Корейського університету, Сеул, Корея). Мишей дикого типу (WT) (PRMT1 +/+) асоціювали з гетерозиготними PRMT1 +/-, а брати та сестри використовувались в експериментах після генотипування. Усі миші були утримувані в певному безпатогенному стані при кімнатній температурі 22 ± 1 ° C з вологістю 50%. Мишам-самкам 7 тижнів WT (n = 6) та PRMT1 +/- (n = 6) мишей проводили OVX шляхом видалення двосторонніх яєчників дорсальним підходом під загальною анестезією ромпуном (10 мг/кг) та золетилом (30 мг)./кг). Була проведена фіктивна операція в групі WT (n = 6) шляхом виявлення двосторонніх яєчників. Через 8 тижнів усіх мишей забивали і їх стегно вилучали для мікрокомп’ютерної томографії (μCT). Для аналізу TRAP кістки фіксували у 10% формаліні та декальцинували зануренням у 10% етилендіамінтетраоцтову кислоту (EDTA) на 10 днів. Усі дослідження на тваринах були схвалені Інституційним комітетом з догляду та використання тварин (IACUC) Національного університету Чоннам (номер затвердження: CNU IACUC-YB-2016-32).
Вестерн-блот
Клітинні гранули лізували в реагенті для екстракції білка ссавців (Thermo, IL, США), що містить коктейль інгібітора протеази (Sigma, MO, США) та інгібітор фосфатази I + II (Sigma, MO, USA). Кожен фракційний білок екстрагували згідно з інструкціями виробника. Кількісний рівень білка визначали методом Бредфорда. Екстракти цілих клітин (по 30 мкг кожен) відокремлювали електрофорезом у поліакриламідному гелі додецилсульфату натрію (SDS-PAGE) і переносили на ампліфіковані нітроцелюлозні мембрани. Потім мембрани промивали буферним сольовим розчином Tris 20 (TBST), блокували 5% знежиреним молоком протягом 1 години та інкубували з первинними антитілами (у розведенні, рекомендованими постачальником) протягом ночі при 4 ° C. Мембрани потім промивали TBST та інкубують з вторинними антитілами, кон'юговані з пероксидазою хрону антитіла протягом 2 годин при кімнатній температурі. Смуги візуалізували за допомогою люмінесцентного аналізатора зображень (ImageQuant LAS 4000, GE Healthcare, Великобританія) з використанням реагентів Amersham ECLTM Western Blotting Detgents (GE Healthcare, Великобританія).
Тести на резорбцію кісток та фарбування актинового кільця
Для аналізу кісткової резорбції BMDM культивували протягом 4 днів за допомогою M-CSF (30 нг/мл) у присутності або відсутності RANKL (100 нг/мл) на поверхневій пластині для аналізу Osteo (Corning Inc., NY). Щоб кількісно визначити розриви в резорбції, клітини видаляли за допомогою 20% SDS, з подальшим великим промиванням дистильованою водою та сушінням на повітрі. Області, поглинені дисками, спостерігали під мікроскопом (Eclipse Ni-U, Nikon, Японія). Для оцінки утворення актинового кільця остеокластоподібними клітинами зрілі остеокласти BMDM готували обробкою M-CSF (30 нг/мл) у присутності або відсутності RANKL (100 нг/мл) протягом 3 днів на покривному склі. клітини фіксували і проникали 0,2% -ним сольовим розчином, забуференним фосфатом Triton X-100 (PBS), з подальшим фарбуванням Alexa Fluor 594-фалоїдином (Invitrogen). Потім клітини висівали і ядра фарбували 4 ', 6-діамідино-2-феніліндолом (DAPI) в монтажному середовищі ProLong Gold Antifade (Invitrogen, Carlsbad, CA, USA).
трансфекція міРНК
Невеликі заважаючі РНК (siРНК) для PRMT1 (Санта-Крус) та контрольні siRNA (Qiagen) використовувались для замовчування ендогенної експресії PRMT1. Кожна siРНК (50 нМ) трансфікувалася в BMDM за допомогою реагенту LipofectamineTM RNAiMAX (Карлсбад, Каліфорнія, США) після методу прямої трансфекції відповідно до інструкцій виробника.
Ланцюгова реакція в реальному часі (qPCR)
Загальну РНК екстрагували з клітин за допомогою TRIzol, монофазного розчину фенолу та гуанідину ізотіоціанату, придбаного в Invitrogen (Карлсбад, Каліфорнія, США). Потім 1 мкг РНК реверсували в комплементарну ДНК (кДНК), використовуючи систему зворотної транскрипції RT Premix (AccuPower, Сеул, Корея) з праймерами oligo-dT18. Потім qPCR проводили з використанням кДНК як шаблону з використанням Power SYBR Green (Applied Biosystems, Warrington, UK). Були використані такі праймери: PRMT1, 5'-CCTCACATACCGCAACTCCA-3 'і 5'-CATCCAGCACCACCTTGTCT-3'; c-fos, 5'-CCAGTCAAGAGCATCAGCAA-3 'та 5'-AAGTAGTGCAGCCCGGAGTA-3'; NFATc1, 5'-CTCGAAAGACAGTGGAGCAT-3 'і 5'-CGGCTGCCTTCCGTCTCATAG-3'; TRAP, 5'-CTGGAGTGCACGATGCCAGCGACA-3 'і 5'-TCCGTGCTCGGCGATGGACCAGA-3'; катепсин K, 5'-GGCCAACTCAAGAAGAAAAC-3 'і 5'-GTGCTTGCTTCCCTTCTGG-3'; ПЕЧАТ постійного струму, 5'-CCAAGGAGTCGTCCATGATT-3 'та 5'-GGCTGCTTTGATCGTTTCTC-3'; та β-актин, 5'-AGGCCCAGAGCAAGAGAG-3 'та 5'-TCAACATGATCTGGGTCATC-3'. Дані QPCR нормалізували, використовуючи β-актин як ендогенний контроль. ПЛР у режимі реального часу проводили на системі ПЛР у режимі реального часу Rotor-Gene Q (Qiagen, Hilden, Німеччина) з використанням двоступеневого протоколу 95 ° C протягом 10 с, а потім 40 циклів 60 ° C протягом 60 с.
Імуноферментний аналіз (ІФА)
Концентрацію ADMA в супернатанті культури вимірювали за допомогою ультразвукового набору ELISA (Eagle Biosciences, Nashua, NH, USA) відповідно до інструкцій виробника.
Імунофлуоресценція та конфокальна мікроскопія
Клітини двічі промивали PBS і фіксували протягом 10 хвилин 4% параформальдегідом у PBS. Після трьох промивань у PBS фіксовані клітини просочували 0,2% Triton X-100 і використовували 1% розчин бичачого сироваткового альбуміну для блокування. Клітини інкубували з антитілом PRMT1 (співвідношення розведення 1: 100) протягом 15 годин при 4 ° C. Після трьох промивань у PBS клітини інкубували з вторинними антитілами до флюоресцеїну ізотіоціанату кролика (FITC) (Sigma, MO, USA). Потім клітини розміщували на предметних стеклах, а ядра візуалізували за допомогою DAPI. Візуалізацію імунофлюоресценції проводили на лазерному скануючому мікроскопі Leica TCS SP5 AOBS (Leica Microsystems, Гейдельберг, Німеччина), використовуючи масляну мішень Leica 63 × (NA 1, 4), розташовану в центрі Кванджу в Кореї. Збудження (496 та 405 нм) та випромінювання (500 - 535, 449 - 461 нм) спостерігалися для кон'югованої з FITC конструкції та DAPI. Для всіх експериментів час експозиції залишався однаковим для всіх зразків.
Аналіз на люциферазу
Для аналізу люциферази необроблені 264,7 макрофаги були тимчасово котрансфіковані pGL4.32-luc2P/NF-KB-RE (Promega, WI, США) та контролем або PRMT1 з вектором експресії β-галактозидази для нормалізації експресії репортерного гена з використанням ліпофектаміну 3000 ( Invitrogen, Карлсбад, Каліфорнія, США). Через 48 годин після трансфекції культуральне середовище замінювали середовищем, що містить RANKL, з подальшою інкубацією протягом 24 годин. Клітини лізували пасивним буфером для лізису. Активність промотору вимірювали за допомогою жука люциферину та люмінометра GLOMAX. Реагенти для вимірювання активності люциферази були придбані у Promega.
Імунопреципітація
Клітини RAW 264,7 інкубували з або без RANKL (100 нг/мл) у присутності M-CSF (30 нг/мл) протягом 24 годин. Клітини лізували в неденатурирующем буфері для лізису, складеному з 20 мМ Tris (рН 7,4), 150 мМ NaCl, 1% NP-40, 1 мМ EDTA і 5% гліцерину. Потім 200 мкг білка інкубували з антитілом PRMT1 та 40 мкл білка агарози G в неденатурирующих умовах протягом 24 годин при 4 ° C. Імунопреципітати промивали інтенсивно, ресуспендували в 2-кратному буфері зразків, кип’ятили протягом 7 хвилин і іммуноблотували.
аналіз μCT
Для зображення μCT дистальних відділів стегнової кістки була використана система Skyscan 1076 з високою роздільною здатністю. Сировинні зображення були реконструйовані в серійні зображення поперечного перерізу з однаковими пороговими значеннями для всіх зразків за допомогою програмного забезпечення для реконструкції зображень версії 3.1. Всього 240 сходинок трабекулярних кісток проксимального відділу стегнової кістки, починаючи з 80 сходинок від епіфізної пластинки, були вручну визначені як цікаві ділянки. Морфометричні параметри стегнової кістки визначали за допомогою програмного забезпечення для аналізу даних (CTAn). Трабекулярна морфометрія характеризувалася вимірюванням об’єму кістки на об’єм тканини (BV/TV), трабекулярного числа (Tb. N), товщини трабекули (Tb. Th) та мінеральної щільності кісткової тканини (BMD).
Статистичний аналіз
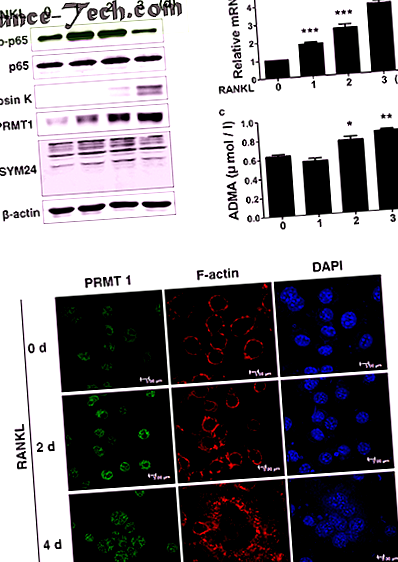
Всі статистичні аналізи визначали за допомогою GraphPad Prism 5 (GraphPad, La Jolla, CA, USA). Статистичні значення розраховували за допомогою t-критерію Стьюдента для порівняння середніх значень двох груп. Односторонній дисперсійний аналіз (ANOVA) з пост-хок-тестом Тукі був використаний для порівняння відмінностей між кількома значеннями для оцінки відмінностей між конкретними групами. Результат вважався статистично значущим, якщо значення Р становило 25, 26. Примітно, що рівні протеїну PRMT1 та ADMA зростали у відповідь на лікування RANKL під час диференціації остеокластів (рис. 1а). Рівень експресії мРНК PRMT1 та концентрація ADMA в супернатанті культури також були збільшені в диференційованих клітинах, оброблених RANKL (рис. Lb, c). Як показано на фіг. 1d, лікування M-CSF та RANKL індукує чітко визначене утворення кільця F-актину, яке пов'язане з прикріпленням остеокластів до поверхні кістки, і це супроводжується збільшенням експресії PRMT1 в ядрі.
оголошення BMDM культивували M-CSF (30 нг/мл) та RANKL (100 нг/мл) протягом зазначених періодів часу, щоб викликати диференціювання у зрілі остеокласти. Клітинні білки екстрагували та вестерн-промокали зазначеними антитілами. b Результати ПЛР у режимі реального часу, що показують рівень експресії мРНК PRMT1. Результати нормалізували до рівня експресії β-актину. c Рівень експресії ADMA в супернатанті культури визначають методом ІФА. Результати виражаються як середнє значення ± SD. * стор
Клітини RAW 264,7 трансфікували контролем або siRNA PRMT1 згідно з методом прямої трансфекції. Через 24 години клітини трансфікували плазмідами pGL4.32 - luc2P/NF-KB-RE та β-галактозидазою. Після 24 годин трансфекції клітини обробляли RANKL (100 нг/мл) у присутності M-CSF (30 нг/мл) протягом 24 годин, а потім лізували пасивним буфером для лізису для аналізу люциферази. Активність люциферази вимірювали та нормалізували до активності β-галактозидази. Дані представлені як середнє значення ± SD. *** p +/-. Через вісім тижнів після ОВХ на трабекулярній кістці дистального відділу стегнової кістки проводили гістоморфометричний та μCT-аналіз. Сагітальний гістоморфологічний парафіновий зріз стегнової кістки піддавали фарбуванню TRAP. Остеокластична активність була суттєво підвищена в метафізі мишей WT OVX, але не у мишей PRMT1 +/- OVX (рис. 6а). Морфометричний аналіз мікро-КТ показав, що OVX призвів до помітного зниження МЩКТ, BV/TV, Tb. N і Tb. Th у мишей WT (рис. 6b, c). Однак таке зменшення було скасовано у мишей PRMT1 +/- OVX (Фігури 6b, c). Ці результати вказують на те, що дефіцит PRMT1 може захистити мишей від індукованої OVX втрати кісткової маси.
TRAP-фарбування дистальних відділів стегнової кістки проводили з використанням наборів фосфатази лейкоцитарної кислоти та спостерігали під мікроскопом (стрілка). b Показані репрезентативні двовимірні зображення стегнових кісток. c Об’єм кісток на об’єм тканини (BV/TV), число трабекул (Tb. N), товщину трабекулярної трубки (Tb. Th) та мінеральну щільність кісткової тканини (BMD) визначали з вимірювань μCT (n = 6). * p +/- OVX миші пригнічують активність остеокластів і втрату кісткової тканини, і що стимуляція E2 є достатньою для блокування диференціації остеокластів RANKL 30, ми далі досліджували, чи може впливати на експресію PRMT1 17β-естроген (E2) під час диференціації остеокластів in vitro. BMDM попередньо обробляли E2, а потім обробляли білком RANKL та PRMT1 та визначали рівні мРНК PRMT1. Результати показали, що експресія генів, опосередкована RANKL, і рівень експресії білка PRMT1 були придушені лікуванням E2 при BMDM (рис. 7а, b). Крім того, ICI 182, 780, антагоніст ER, скасував інгібуючий ефект E2 на експресію PRMT1 (рис. 7c, d). Ці результати свідчать про те, що E2 може мати захисний ефект проти остеопорозу, зменшуючи експресію PRMT1.
a, b BMDM попередньо обробляли з або без E2 (1 мкМ) протягом 2 годин, а потім обробляли RANKL (100 нг/мл) протягом 24 годин. Експресію білка PRMT1 досліджували за допомогою Вестерн-блот. b Рівень мРНК PRMT1 вимірювали за допомогою ПЛР у реальному часі, а потім нормалізували до рівня β-актину. c, BMDM попередньо обробляли E2 (1 мкМ) з попередньою обробкою або без неї ICI 182, 780 (10 мкМ). Через 2 години клітини обробляли RANKL (100 нг/мл) протягом 24 годин. Білки екстрагували та піддавали Вестерн-блот-аналізу з антитілами PRMT1 та β-актином. Дані представлені як середнє значення ± SD. * p +/-) миші, і ці результати свідчать про те, що PRMT1 може сприяти диференціації остеокластів та остеопорозу.
Попередні дослідження показали, що ADMA, продукт PRMT типу 1, може брати участь у розвитку остеопорозу. Канадзава та ін. повідомляється, що у пацієнтів з діабетом рівні диметиларгініну в сироватці крові пов’язані з наявністю переломів хребців 31. Лу та ін. продемонстрували, що підвищення рівня ADMA в сироватці крові пов'язане із віковим зниженням МЩКТ32 щурів. У цьому дослідженні ми виявили, що рівні ADMA зростали в середовищі культури клітин під час індукованої RANKL диференціації остеокластів. Хоча кілька досліджень повідомляли, що ADMA пов'язаний з різними метаболічними захворюваннями 33, 34, необхідні подальші дослідження, щоб виявити точну роль ADMA як фактора ризику в диференціації остеокластів та остеопорозі. Крім того, вони повинні з'ясувати клінічне значення рівнів ADMA у пацієнтів з остеопорозом.
На закінчення, наші результати показали, що експресія PRMT1 була збільшена в ядрі BMDM, обробленому RDMKL, через опосередкований JNK сигнальний шлях (рис. 7е). PRMT1 був важливим для індукованої RANKL активності остеокластів, резорбції кісток та регуляції генів, пов'язаних з остеокластогенезом. Крім того, дефіцит PRMT1 знижує остеокластичну активність in vivo та втрату кісткової маси у мишей OVX. Таким чином, PRMT1 може бути терапевтичною мішенню для лікування розвитку та прогресування остеопорозу.
Дякую
Це дослідження було підтримане грантом (2017R1D1A1A02019106) від Національного дослідницького фонду (NRF), що фінансується урядом Кореї.
- Ендометріоз сприяє привабливості жінок Unilabs
- Пецифічна делеція traf3 в b-лімфоцитах призводить до розвитку b-лімфоми у мишей - лейкемії
- Чи сприяє медична страхова компанія дієті без глютену. Якщо так, то для чого; Економічна нарада
- Ви відчуваєте зниження працездатності та втому. Ваше життя може бути в небезпеці
- PELION - Угорщина - Tapolca - найнижча ціна від 0 € - HELLAS TRAVEL