предметів
реферат
9-11 нм) з діаметром пор
Результати та обговорення
Взаємодія Ang II з лізеніновими каналами збільшує тимчасові зміни іонного струму
Основна експериментальна установка для аналізу взаємодій між Ang II та окремими каналами лізеніну, яка є загальною для досліджень транслокації макромолекул, детально описана в розділі Методи. Введення одиночного каналу лісеніну в мембрану вказувалось постійним струмом відкритого струму
-122 пА при потенціалі зміщення -60 мВ (рис. Ла), після чого розчин у цис-водоймі обмінювали на безлісеніновий електроліт, щоб запобігти подальшому введенню. Однак після зміни буфера можна вставити більше каналів, оскільки утворення попередніх пор, прикріплених до мембрани, є умовою олігомеризації каналів 36. Хоча ми не виявили жодних змін в характерних електронних підписах, отриманих в результаті одноканальних вимірювань до шести вбудованих нанопортів (після чого електричний шум може стати значним і перешкоджати точному аналізу), всі експерименти з транслокації на окремих каналах постійно містили дві нанопори лізеніну, зібрані в ліпідна мембрана.
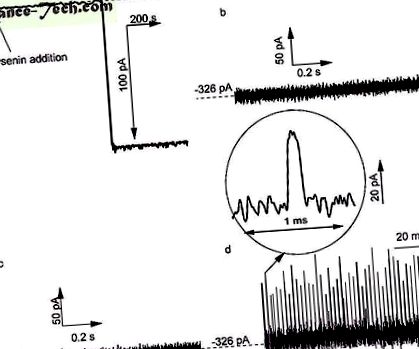
Взаємодія Ang II з одинарними лізеніновими каналами, вбудованими в ліпідні мембрани, купані з 1 М розчинами KCl, забуференними 10 мМ Трис та 1 мМ ЕДТА при рН 6,9. a ) Введення одного каналу в двошарову мембрану спостерігалося як ступінчаста зміна іонного струму при трансмембранному потенціалі -60 мВ (час дискретизації 1 с, апаратний фільтр низьких частот 1 кГц та програмний фільтр низьких частот 10 Гц) . Жодних перехідних змін іонного струму, визначених через два відкриті лізинові канали, не спостерігалося при -80 мВ, коли: ( b ) до розчину не додавали Ang II і (( c ) Ang II був доданий до водосховища. ( d ) Додавання Ang II до цистерни цис забезпечило багаторазові перехідні зміни іонного струму, що вказує на взаємодію каналу і пептиду. Сліди, показані на панелях ( b - d ) були записані з часом дискретизації 4 мкс та апаратним фільтром низьких частот 10 кГц.
Повнорозмірне зображення
За відсутності пептидного аналіту Ang II, доданого до зовнішніх розчинів, слід іонного струму, записаний по двох каналах при -80 мВ і високій роздільній здатності (час відбору проб 4 мкс), показав відсутність будь-яких перехідних змін у відкритому сліді струму (рис. . 1b) та низький рівень шуму (1 Ang II) у резервуар (головна сцена) для інакших експериментальних умов та часового діапазону (рис. 1c), що вказує на те, що певний напрямок електричного поля запобігає будь-яким взаємодіям нанопор і аналітів. додавання пептиду до цис-резервуару при трансмембранному потенціалі -80 мВ дало часті та короткі перехідні зміни іонного струму (рис. 1г), що вказує на пептидні взаємодії з відкритим каналом 13, 14, 15, 16, 42, 43 44, 45, 46 .
Два основні типи записаних подій можна класифікувати як переміщення або зіткнення
Раптові та тимчасові зміни іонного струму, викликані додаванням Ang II до цис-сторони, подібні до електронного підпису пептидів, що взаємодіють з іншими біологічними нанопорами 11, 14, 16, 43, 44, 45, 46. Поглиблений аналіз електронного перехідного підпису за допомогою програмного пакету Transalyzer 47 був проведений для кожної окремої події з точки зору середньої зміни струму під час перехідної блокування та часу перебування, tD. Графік щільності подій, зафіксований при -80 мВ (рис. 2а), показав два кластери, загальне явище, яке відбувається для макромолекул, переміщених через синтетичні та природні нанопори 11, 14, 43, 48. Наявність двох кластерів свідчить про різну сигнальну взаємодію пептидних каналів, що може представляти протилежну орієнтацію молекул, що надходять у нанопору 7, згортання, олігомеризацію 11, зв'язування 46 або невдалі спроби транслокації, коли молекули стикаються лише з отвором каналу 14, 43. Кластери, показані на фіг. 2a різні, і тому їх можна легко розділити на два класи подій, що називаються E1 та E2. Подальший аналіз подій, що належать кожному класу, показав відносно вузький та симетричний розподіл (рис. 2b), з піками при -26 pA (події E1) та -10 pA (події E2).
Аналіз блокуючих подій, зареєстрованих після додавання Ang II до цистерни цис при трансмембранному потенціалі -80 мВ. ( a ) Графік щільності показує два чітко визначені кластери (звані E1 та E2), що дозволило проводити окремий аналіз кожного окремого кластера. Колір позначає щільність відповідно до вставленої шкали. ( b ) гістограми (ширина пласта 3 пА) представляють піки при -26 пА (події E1) та -10 pA (події E2). ( c ) Розподіл подій для кожного з двох кластерів в термінах tD представлений гістограмами (ширина стека 0,02 мс) з піками на
70 мкс (події E1) a
120 мкс (події E2). Для кращого спостереження розподілів, що перекриваються, було введено проміжок між бінами подій E2. Проаналізовані події були зібрані в одному експерименті з транслокацією.
Повнорозмірне зображення
описуючи події E1 або E2 представляють менше 25% від абсолютного значення струму відкритого струму, що набагато менше, ніж вимірюється в експериментах, що вивчають транслокацію пептидів або коротких полінуклеотидів в інших біологічних нанопорах 8, 14, 16, 4349. Цю невідповідність можна пояснити структурними властивостями як каналу, так і пептиду. Опублікована нещодавно структура лізеніну 35, 36 показує довжину каналу
Розподіли tD для двох кластерів (рис. 2в), зафіксовані при -80 мВ, є косими і асиметричними, з піками при
70 мкс (події E1) a
120 мкс (події E2). На відміну від поточних блокових розподілів, які добре відокремлені, ми спостерігали велике перекриття між характеристиками t Ds двох типів подій. Крім того, події E1 показали вузький розподіл tD, тоді як події E2 перевищили діапазон від 0,02 мс до більше 0,4 мс (рис. 2в). Попередні вимірювання ts для пептидів або коротких олігонуклеотидів, переміщених через α-HL або аеролізинові канали, показують розподіли, які слідують за експоненціальними розпадами, описаними характерними часами релаксації, як показник середнього значення Tn 11, 13, 14, 16, 43, 46, 49. Наші результати можуть не відповідати такому опису, оскільки жоден з двох класів подій не може бути точно описаний як комбінація експоненціальних спадів.
Залежність від стресу взаємодій між окремими каналами лізеніну та Ang II. ( a ) Середнє значення подій E1 (відкриті квадрати) слідувало за лінійно прикладеною напругою, як очікувалося для транслокацій. На відміну від цього, прикладена напруга мала значно менший вплив на поточну блокування, що характеризує події E2 (суцільні квадрати). ( b ) Середнє t D перехідних завалів зменшувалось із прикладеною напругою для подій E1 (відкриті квадрати) та E2 (суцільні квадрати). Дані на обох панелях виражаються як середнє значення ± sd, n = 3; кожен обсяг вибірки складався щонайменше з 2800 подій.
Повнорозмірне зображення
Як ми вже тлумачили раніше, ми призначили події, що характеризуються меншим блокуванням струму та більшим часом взаємодії, що містять молекули, які впливають на пори та дифундують 14, 43. На відміну від цього, більші поточні блокади та коротший час вважалися характерними для передбачуваних транслокацій 14, 43. В результаті ми робимо висновок, що події E1 характерні для переміщених молекул, а події E2 - зіткнення з порами. Однак ми не можемо повністю виключити можливість кластеризації на фіг. 2а, що походять з різних орієнтацій молекул, що надходять у пори 52, пептидного згортання або інших складних міжмолекулярних взаємодій між лізеніновими каналами та пептидами 46. Електронний підпис пептидів, які проходять через нанопори, сильно залежить від природи аналіту та нанопор, що ускладнює порівняння між експериментами з транслокації, для яких жоден з них не є однаковим.
Далі ми досліджували вплив прикладеної напруги на частоту подій для двох різних груп населення. Як показано на фіг. 4, частота подій E1 або E2 зростала квазілінійно із збільшенням амплітуди трансмембранної напруги, що раніше спостерігалося при транслокації коротких нуклеотидів або пептидів 8, 13. Широкий розподіл експериментальних значень частоти, як показано великим діапазоном похибок, можна пояснити нерівномірним змішуванням розчинів після додавання Ang II. Ми також спостерігали, що частота подій зростала з часом, що можна пояснити електричним накопиченням пептидів поблизу отвору каналу. Варто зазначити, що числа були розподілені відносно рівномірно між двома популяціями, незалежно від використовуваної напруги.
Вплив напруги на частоту подій. Частота подій E1 ( a ) та E2 ( b ), розрахована для окремого каналу лізину, слідує за прикладеною напругою квазілінійним способом. Експериментальні точки представляють середнє значення ± sd, n = 3.
Повнорозмірне зображення
Докази транслокації: LC-MS аналіз
22 700). як описано в розділі про методи).
Після додавання Ang II до цис-водойми (кінцева концентрація 10 мкг мл -1) при -100 мВ протягом приблизно 36 годин, розчин видаляли з резервуару для подальшого аналізу. LC-MS показав присутність Ang II у стандартному зразку та у розчині, взятому з резервуару-транссексуалу (рис. 5a-d), вказуючи на проходження Ang II через мембрану, що містить велику популяцію лізенінових каналів. Кількість транслокованого Ang II (
0,8 нг), розрахована з калібрувальної кривої MS-LC стандартних величин, була використана для розрахунку частоти транслокації
Докази транслокації Ang II у великих популяціях лісенінових каналів, вбудованих у плоску ліпідну мембрану. ( a ) MS контрольного розчину Ang II (100 нг) ідентифікував пептид при m/z = 349,5 (z = 3+). b ) РХ-хроматограма еталонного розчину Ang II. Пептидні молекули, переміщені в транс-резервуар при -100 мВ протягом 36 годин, були виявлені та ідентифіковані MS ( c ) та LC ( d ). Застосування напруги +100 мВ ( e ) або блокування каналу хітозану ( f ) не дозволяв LC виявляти Ang II у резервуарі.
Повнорозмірне зображення
Можна стверджувати, що за вищезазначених експериментальних умов протилежне електричне поле може також запобігати транслокації через негерметичну мембрану, або що канали лісеніну можуть створювати зміну напруги, приймаючи підпровідні стани 41, що характеризуються зменшеним діаметром провідного шляху, який несумісний з великою молекулою транслокація. Тому ми провели подібний експеримент, коли мембрану відхиляли на -100 мВ (для сприяння транслокації), але канали лісеніну піддавали дії хітозану, незворотного блокатора провідності каналу лізеніну 58. LC-аналіз зразків, вилучених з водосховища, не показав присутності Ang II (рис. 5f). Хоча можливо, що спонтанна транслокація Ang II відбулася на рівнях нижче межі виявлення LC-MS, очевидно, що відкриті канали лізеніну, введені в мембрану, відповідальні за посередництво електрофоретично контрольованою транслокацією Ang II, яке спостерігалося в цьому дослідженні. Разом з електронним підписом, записаним на окремих каналах лізеніну у присутності пептиду, наша робота демонструє, що канали лісеніну дозволяють пептиду перетинати мембрану через провідний шлях нанопор.
висновки
Ми успішно продемонстрували, що лізинові канали, вбудовані в ліпідні мембрани, полегшують транслокацію пептидних молекул, електрофоретично керованих електричними полями. Це дослідження додає лізенін до короткого списку перспективних пороутворюючих білків, придатних для розробки приладів, що сприймають і характеризують природу. Великий і рівномірний діаметр каналу може містити молекули, які занадто великі, щоб їх витіснили інші біологічні нанопорту, розширюючи тим самим можливості сканування нанометрів для інших біомолекулярних аналітів. Подальша інженерія каналів за допомогою хімічних модифікацій та спрямованого на місце мутагенезу для впровадження вдосконалених або навіть нових сенсорних можливостей тепер можлива завдяки останнім структурним даним зібраних пор 35, 36. Крім того, канали лізеніну представляють незвичні механізми регуляції фізичними та хімічними подразниками, такими як напруга або ліганди 41, 54. Зовнішня модуляція провідного стану може надалі використовуватися для контрольованого транспорту біоактивних молекул через природні та штучні ліпідні мембрани, тимчасової проникнення клітин, систем доставки ліків, інтелектуальних комутаторів та біоелектроніки.
методи
Підготовка двошарових ліпідів Підготовка мембрани та введення каналів
Спрощений ескіз експериментальної установки для транслокації Ang II. Окремі лізинові канали, вбудовані в плоскі двошарові ліпідні мембрани, уражені трансмембранними стресами, можуть полегшити електрофоретично керовану транслокацію макромолекул через великий провідний шлях. Розміри каналу - від посилання 35.
Повнорозмірне зображення
Транслокація пептиду через окремі канали лісеніну
Ang II додавали в цистерну з кінцевою концентрацією 1 мкг мл-1 з подальшим перемішуванням протягом приблизно 10 секунд. Перехідні події реєстрували за протоколом змінної довжини за час дискретизації 4 мкс, 1 мс до і після запуску, апаратний фільтр 10 кГц і зберігали для аналізу за допомогою Clampfit 10.2 (Молекулярні пристрої), Transalyzer 47, Matlab (Mathworks), та Origin. 8.5 (OriginLab Corporation). Час перебування розраховували як максимальний напівмаксимум для кожної окремої події, обраної для аналізу, а поточні амплітуди розраховували як середній рівень між першим та останнім локальним мінімумом кожної події 47. Ця процедура забезпечила найкраще розділення подій E1 та E2.
Інсерція великих популяцій лізинових каналів
Експериментальний протокол для вставки декількох каналів у подвійний шар був подібним до окремих каналів, але включав більший діаметр отвору в плівці з ПТФЕ
В середньому 180 мкм для розміщення більшої популяції каналів). Більшу кількість лізеніну додавали в цистерну (до 20 мкл 1 мкМ) і використовували менший об'єм електроліту в резервуарі (100 мкл). Загальну кількість вставлених каналів поступово збільшували шляхом поступового додавання лізеніну до досягнення постійного іонного струму.
-180 нА при трансмембранній напрузі -4 мВ, а потім буферний електроліт змінювали для видалення лізеніну з основного розчину. Кількість каналів, присутніх у мембрані (
22 700) було оцінено за співвідношенням між сумарною провідністю мембрани, визначеною за IV кривою, записаною для вузького діапазону напруги (рис. 7), та індивідуальною провідністю каналу (рис. 7).
IV графік для великих популяцій лізенінових каналів, вбудованих у двошарову ліпідну мембрану. Провідність, обчислену з нахилу кривої, використовували для оцінки кількості вставлених каналів.
Повнорозмірне зображення
Блокада лізенінових каналів хітозаном. Додавання хітозану викликало постійне і незворотне зниження макроскопічної провідності при трансмембранному потенціалі -4 мВ, що вказує на блокаду каналу.
Повнорозмірне зображення
LC-MS аналіз
Дякую
Дослідження, представлені в цій публікації, підтримали Національний науковий фонд (грантові номери 1554166, 0923535), Національні інститути охорони здоров’я (грантові номери P20GM109095, P20GM103408) та Національне управління аеронавтики та космосу (грантовий номер NNX15AU64H). Вміст несе виключну відповідальність авторів і не обов'язково відображає офіційні погляди агентств допомоги.
Коментарі
Надсилаючи коментар, ви погоджуєтесь дотримуватися наших Загальних положень та умов та Правил спільноти. Якщо ви вважаєте, що це образливий вчинок, який не відповідає нашим умовам чи інструкціям, повідомте про це як про недоречний.