Перегляньте статті та зміст, опубліковані в цьому носії, а також електронні зведення наукових журналів на момент публікації
Будьте в курсі завжди, завдяки попередженням та новинам
Доступ до ексклюзивних рекламних акцій на підписки, запуски та акредитовані курси
Clínica Las Condes Medical Journal (RMCLC) - науковий орган розповсюдження Clínica Las Condes, надзвичайно складної приватної чилійської лікарні, яка пов'язана з медичним факультетом Чилійського університету та акредитована Міжнародною спільною комісією. Цей щомісячний журнал публікує бібліографічні огляди біомедичної літератури, оновлення, клінічний досвід, отриманий з медичної практики, оригінальні статті та клінічні випадки з усіх галузей охорони здоров’я.
Кожне видання структуровано навколо центральної теми, яку організовує запрошений редактор, що спеціалізується на цій галузі медицини. Статті детально розробляють цю центральну тему, враховуючи їхні різні точки зору, і написані висококваліфікованими авторами з різних закладів охорони здоров’я, як чилійських, так і закордонних. Усі статті проходять процес рецензування.
Мета RMCLC - запропонувати першочерговий приклад оновлення для медичних працівників, крім того, що він є допоміжним інструментом для викладання та слугування навчальним матеріалом для студентів медичних та аспірантських студій та всієї кар'єри в галузі охорони здоров'я.
Індексується у:
Слідкуй за нами на:
- Резюме
- Ключові слова
- Резюме
- Ключові слова
- Вступ
- Резюме
- Ключові слова
- Резюме
- Ключові слова
- Вступ
- Генетика та патофізіологія
- Стовпи лікування МВ
- Синтез
- Бібліографія
Виживання та якість життя хворих на муковісцидоз (МВ) за останні десятиліття надзвичайно покращилися до того ступеня, що він перетворився зі смертної хвороби в дитячому віці на досить хронічну хворобу, з більшістю випадків у зрілому віці. Це пояснюється кращим знанням патології, її все більш ранньою діагностикою та профілактичним та агресивним лікуванням ускладнень дихання та харчування у спеціалізованих мультидисциплінарних центрах допомоги. Цей огляд описує поточне управління та ускладнення.
Середня виживаність та якість життя хворих на муковісцидоз помітно зросли за останні десятиліття, змінившись із летальної хвороби на хронічну, у більшості пацієнтів у зрілому віці завдяки кращому знанню про патологію, ранньому діагнозу, та профілактичне та агресивне лікування респіраторних та харчових ускладнень, що проводиться у спеціалізованих та багатопрофільних центрах. У цій статті описано сучасне лікування захворювання та його ускладнення.
З моменту його опису в 1938 році доктором Дороті Андерсен 1, муковісцидоз (МВ) був визначений як найбільш поширене летальне генетичне захворювання у кавказців. Однак в даний час, коли більше половини хворих на МВ є дорослими, видається більш доцільним зняти відтінок летального та визначити його як хронічне генетичне захворювання, багатосистемне прояв і прогноз якого залежить від ранньої діагностики та суворого терапевтичного лікування. управління в спеціалізованих центрах.
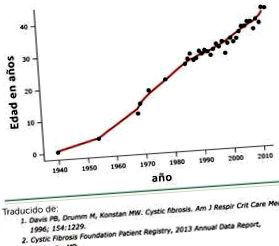
Медіана виживання хворих на ХФ значно зросла, досягнувши в даний час 41 рік (рисунок 1), причому більше половини пацієнтів досягли зрілого віку 2 (малюнок 2). Цей великий прогрес у життєвому прогнозі в основному зумовлений кращими знаннями етіопатогенезу та патофізіології захворювання, терапією, що підтверджується доказами добре розроблених клінічних досліджень, та медичним управлінням у центрах МВ із мультисистемним підходом.
МЕДІАННЕ ВИЖИВАННЯ У ХВОРИХ НА ЦІСТИЧНИЙ ФІБРОЗ
Взято з річного звіту 2014 року Фонду муковісцидозу США.
КІЛЬКІСТЬ ДІТЕЙ І ДОРОСЛИХ З ЦИСТИЧНИМ ФІБРОЗОМ (МВ) 1986-2014
Взято з Річного звіту 2014 року Фонду муковісцидозу США.
В останні роки з’явилися нові методи лікування, спрямовані на виправлення основного дефекту захворювання, що створило велику надію на швидке досягнення остаточного лікування хвороби. Поки цього не відбувається, важливо застосовувати терапію, спрямовану на запобігання та корекцію ускладнень МВ.
Основною метою цього огляду є оновлення поточного терапевтичного лікування захворювання.
ГЕНЕТИКА ТА ПАТОФІЗІОЛОГІЯ
Щоб зрозуміти методи терапії, спрямовані на поліпшення виживання та якості життя, слід пам’ятати його етіопатогенез та походження ускладнень. Відомо, що це генетичне, аутосомно-рецесивне захворювання, результат мутації гена, розташованого на довгому плечі 7-ї хромосоми, який кодує вироблення складного білка, що називається CFTR, для його абревіатури англійською мовою (“трансмембранний регулятор муковісцидозу ”), Присутній у численних епітеліях і виконує функцію каналу або пори для проходження хлоридного іона 3,4,7 (рис. 3).
УТВОРЕННЯ КАНАЛУ CFTR АБО ХЛОРУ
З часу його відкриття в 1989 р. Було описано 5,6 понад 2000 мутацій гена CFTR, які класифікуються на 6 груп залежно від механізму продукування дефекту білка 9 (рис. 4). Класи I, II та III спричиняють повну відсутність хлорного каналу, тоді як класи IV, V та VI призводять до часткової недостатності білка. Якщо обидві мутації конкретного випадку відносяться до перших трьох, результуючий фенотип буде важким із недостатністю підшлункової залози. Навпаки, присутності мутації останніх 3 класів в алелі достатньо, щоб отриманий фенотип був м’яким, що визначається наявністю достатньої кількості підшлункової залози 8 .
Повідомляється про захворюваність 1/3500 живонароджених у кавказців та 1/8000 у латиноамериканців.
Недостатність CFTR в різних епітеліях пояснює багатосистемні прояви, включаючи дихальну, травну, печінкову, метаболічну та репродуктивну.
У дихальному епітелії відмова каналу перешкоджає секреції іону хлору в просвіт дихальних шляхів, породжуючи затримку іона натрію і, отже, води, спричиняючи втрату гідратації бронхіального секрету 10. Це зміна характеристик бронхіального слизу призводить до зараження бактеріями, особливо золотистим стафілококом та синьогнійною паличкою, які, додаючи нейтрофільну запальну реакцію хазяїна, в кінцевому підсумку утворюють густі та тягучі секрети, які перешкоджають дихальним шляхам та руйнуються з фіброзом. стінки бронхів (рисунок 5).
Це хронічне запальне явище дихальних шляхів, яке спричиняє анатомічне та функціональне пошкодження МВ, спостерігається з перших тижнів життя, навіть за відсутності явної бронхіальної інфекції в культурах бронхіального секрету. Цей факт підкреслює важливість початку терапії для збереження здоров’я легенів якомога раніше 11 .
СТУПИ ЛІКУВАННЯ МВ
Поточне управління МВ базується на 5 основних опорах, які не можуть не існувати:
-
I)
Діагностика якомога раніше
Зберігайте дихальні шляхи без секрету
Зберігайте дихальні шляхи від інфекцій
Підтримуйте оптимальний харчовий стан
Управління в спеціалізованому багатосистемному центрі
I) РАННЯ ДІАГНОСТИКА
Ідеальним є досягнення діагнозу в перші місяці життя, тому педіатр повинен бути уважним до підозрілих симптомів (табл. 1). Однак пошкодження легенів починається з народження, і дуже ймовірно, що очікування появи симптомів змусить нас приїхати пізно на діагностику 11 .
ПОКАЗАННЯ ТЕСУДОРСТУ
| -Повторні респіраторні симптоми (повторна пневмонія або хрипи, постійний кашель) |
| -Хронічна діарея, погане всмоктування |
| -Затримка розвитку тягарів |
| -Гіпонатріємічна, гіпохлоремічна та гіпокаліємічна дегідратація з метаболічним алкалозом |
| -Набряки та гіпопротеїнемія |
| -Солоний смак шкіри |
| -Меконієвий ілеус |
| -Гепатомегалія |
| -Випадання прямої кишки |
| -Поліпи носа |
| -Тривала жовтяниця новонародженого |
| -Брат з МВ |
Звідси важливість неонатального скринінгу на МВ, який проводиться в більшості розвинених країн і дозволяє виявити всі випадки, а отже і справжню частоту захворювання. Стратегії різноманітні і полягають у взятті імунореактивного трипсину (ІРТ) із зразка крові з п'яти новонародженого на терміні 48-72 години життя (на 7 днів у недоношених). Якщо він високий (понад 60 нг/мл), наступним кроком є повторення ІРТ на другому або третьому тижні життя (новий зразок), або проведення мутаційного дослідження (першого зразка) або вимірювання РАР (білка, асоційованого з панкреатитом ) 12.13. Нарешті, усі підозрювані випадки повинні бути підтверджені двома тестами поту за допомогою техніки Гібсона та Кука (Рисунок 6).
Алгоритм клінічної підозри МВ
II) ЗБЕРІГАЙТЕ ДІАГРАМУ БЕЗ СЕКРЕТІЇ
а) Дихальна кінезітерапія
Він є ключовим і центральним у дихальному лікуванні МВ. Він повинен починатися з моменту встановлення діагнозу і бути частиною повсякденного життя пацієнта. Щодня проводяться мінімум 2 сеанси під час вставання та сну, збільшуючи частоту за необхідності. Батьки повинні навчитися виконувати основні маневри з діагностики, і тоді їх виконуватиме сам пацієнт.
Методики різняться і залежать від віку: у дітей до 3 років - пасивні перкуторні маневри грудної клітки, блокування, вібрації та постуральний дренаж. Після досягнення віку 3 років можна додати примусові методи видиху, що спонукають дитину повільно і поступово дихати, щоб виділення виділилися в центральні дихальні шляхи. У дітей старше 6 років навчають маневрам "аутогенного дренування" 14 .
б) Фармакологічні засоби, що сприяють очищенню секрету
- ДНКаза I (Дорназа альфа): це ендонуклеаза, яка розриває ланцюги ДНК, що виділяються нейтрофілами, що відповідає за високу в’язкість секрету в МВ. Показано, що це покращує роботу легенів, підвищуючи ОФВ1 на 6% у хворих на МВ, старших 6 років, і зменшуючи частоту загострень легенів 15 .
Дослідження його ефекту у дітей раннього віку та немовлят показують сприятливий ефект, зменшуючи захоплення периферичного повітря, демонструючи дію в тонких дихальних шляхах.
Звичайна доза становить 2,5 мг, яку слід розпилювати кожні 24 години щодня та постійно після використання аерозольних бронходилататорів (сальбутамолу) для запобігання бронхоконстрикції.
Більшість клінічних рекомендацій вказують на це у симптоматичних респіраторних хворих старше 6 років із середнім або важким ураженням легенів. Це випливає з того факту, що більшість проспективних досліджень проводились серед дітей старшого віку, здатних виконувати функціональні дослідження (спірометрія). Наш центр поділяє ідею, що дітям дошкільного віку та немовлятам слід починати хронічне вживання Dornase alfa з початку респіраторних симптомів 28–30 .
- Гіпертонічний сольовий розчин на 7%: Досліджувалось, щоб подолати гідратаційну недостатність водного шару бронхіального слизу шляхом розпилення гіпертонічного розчину NaCl на 7%. Незважаючи на те, що це не покращує функції легенів за допомогою статистичного сифніфікації, воно демонструє тенденцію порівняно з плацебо, і, як виявилося, це є корисним, зменшуючи частоту загострень. Застосовується шляхом інгаляції 4 мл по 7% 2 рази на день після постійного застосування бронходилататора. Наші показання, як Дорназа альфа, є у пацієнтів із респіраторними симптомами, незалежно від віку 28–30 років .
III. ЗБЕРІГАЙТЕ ДІАГРАМУ БЕЗ ВІД ІНФЕКЦІЇ
Хронічна ендобронхіальна бактеріальна інфекція є головним фактором, що спричинює прогресуюче погіршення функції легенів та поганий прогноз захворювання. P pseudomonas aeruginosa є бактерією, яка найбільше пов’язана із зазначеним погіршенням стану, і тому вона є ключовою у лікуванні МВ, уникаючи розвитку хронічної інфекції цією бактерією 20. Потрібно пам’ятати, що дихальні шляхи хворого на МВ страждають колонією різними мікробами, спочатку золотистим стафілококом, а пізніше синьогнійною паличкою. Малюнок 7.
Перекладено та взято з Річного звіту 2014 року Фонду муковісцидозу США.
ПОШИРЕНІСТЬ ДИХАТЕЛЬНИХ МІКРООРГАНІЗМІВ ЗА ВІКОВИМИ ГРУПАМИ. 2014 рік
Перекладено та взято з Річного звіту 2014 року Фонду муковісцидозу США.
- Ожиріння та розлади харчової поведінки; n Клінічний медичний журнал Las Condes
- Харчування пацієнта з важким гострим панкреатитом Клінічне керівництво з ведення Колумбійського журналу
- Модель Біол; gico de ense; анза при екстирпації; n медичного журналу ліпоми загальної лікарні
- Роль бобових у їжі; n діючий іспанський журнал про харчування та дієту людини
- Естетична медицина тіла - Медико-естетична клініка MediNorte в центрі Валенсії