предметів
реферат
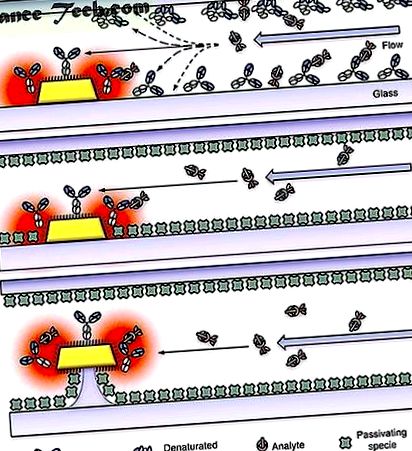
Наноплазмонічне молекулярне сканування в мікрофлюїдних каналах. ( a ) Неспецифічне зв'язування призведе до виснаження як рецепторної, так і цільової молекулярної концентрації, якщо канал не був пасивований, що призведе до уповільненої реакції датчика та великого споживання рецепторів і цілей. Стрілки представляють можливі шляхи взаємодії молекул аналіту. ( b ) Пасивація поверхонь каналів з відповідними блокуючими видами зменшує неспецифічне зв'язування, але блокуючі молекули займають значну частину найбільш чутливого об'єму плазмонного виявлення. ( c ) Збільшуючи частинку металу на оптимізованій нанопильмарі, плазмонічні поля відокремлюються від підкладки та молекул пасивації. Ця конфігурація значно збільшує ефективний обсяг сканування та покращує загальну продуктивність датчика.
Повнорозмірне зображення
Матеріали і методи
Виробництво сенсорних підкладок
Скляні предметні стекла (24 х 24 мм # 5) очищали обробкою ультразвуком в ацетоні та ізопропанолі протягом 5 хвилин, а потім покривали титаном (1 нм) та золотом (50 нм) розпиленням розпиленням, як показано на малюнку 2а. Потім субстрати короткочасно обробляли в кисневій плазмі перед відливанням позитивно зарядженого PDDA (полідіалілдиметиламмоній хлорид, 0,2 об.% У воді, Sigma-Aldrich), як показано на фіг. 2б. Після короткого промивання водою розчин негативно зарядженого кульки полістиролу (ПС) (0,1% у воді, Microparticles GmbH, Німеччина) виливали на підкладки (рис. 2в). Залежно від застосування, або намистини PS видаляли з половини поверхні підкладки за допомогою кубової смужки, або підкладки отримували малюнок за допомогою мікроконтактного друку PDMS (рис. 2г). Самозбірні кульки PS виконували роль маски під час подальшого фрезерування іонним пучком (Ionfab 300, Oxford Instruments, Великобританія; Рисунок 2e). Потім кульки PS видаляли кубиком, а субстрати обробляли в кисневій плазмі для видалення залишкових фрагментів PDDA (рис. 2f).
Виготовлення нанопросторів за допомогою нанопіллів. Етапи виробничого процесу такі:( a ) розпилення матеріалу; ( b ) лиття позитивно зарядженої полімерної плівки; ( c ) самостійне складання негативно зарядженого бісеру з полістиролу (ПС); d ) необов’язкове мікрозображення із використанням штампа PDMS; e ) подрібнення іонним пучком; ( f ) видалення решти бісеру, що залишився, зачищенням стрічки; ( g ) травлення скляної підкладки в BOE; h ) кінцевий мікроскоп із золотими нанодисками на скляних наноступах.
Повнорозмірне зображення
Виробництво структур PDMS
Мікроконтактна друкарська форма виготовлена лазерною літографією на кремнієвій пластині (5-негативний фоторезист mrDWL, Allresist GmbH, Німеччина). Параметри процесу були налаштовані відповідно до рекомендацій виробника. Суміш PDMS без міхурів (10: 1, набір Sylgard 184, Dow Corning, США) наносили на форму при 250 об/хв. Після витримки в темряві протягом
40 годин, цей процес привів до остаточної товщини PDMS. 0,75–1 мм. Клейку мембрану PDMS ретельно відшаровували, прокочували на золотій підкладці з покриттям PS, де вона утримувалася в контакті протягом 10-20 секунд, а потім видаляли одним безперервним рухом. Детальний опис способу виготовлення мікрорідкої PDMS можна знайти деінде 31, 32 .
Оптична спектроскопія
Середні спектри екстинкції реєстрували на спектрофотометрі UV-VIS-NIR (Cary 2000, Agilent Technologies, США). Моніторинг в реальному часі довжини хвилі LSPR для окремих плям сканування проводився за допомогою домашнього модуля вимирання на основі колімованого джерела світла, зв'язаного волокном (HL-2000, Ocean Optics, Данідін, США) та волоконно-спектрометра (BRC711E, B&W Тек, США). Одночасні вимірювання кількох плям сканування проводили за допомогою гіперспектрального пристрою зображення 33, 34, побудованого навколо перевернутого мікроскопа (Eclipse Ti-E, Nikon, Японія), регульованого рідкокристалічного фільтра (LCTF, спектральний діапазон від 650 до 1100 нм, пропускна здатність 7, Роздільна здатність 1 нм, модель Varispec SNIR, PerkinElmer, США) та камера CMOS (Neo5, Andor Technologies, Великобританія). Наша система була спеціально розроблена для паралельного дослідження в режимі реального часу та аналізу на льоту на множинних місцях сканування шляхом синхронізації та контролю всіх основних оптичних компонентів за допомогою власного коду Labview.
Електродинамічне моделювання
Симуляції розподілу оптичного спектра та ближнього поля проводили з використанням комерційної реалізації часово-диференціальної часової області (FDTD) (Lumerical, Inc., Канада) з оптичними константами для золота на основі 35 та формулою загального поля/розсіяного поля. D = 172, 200 або 280 нм, товщина t = 60 нм, кривизна верхнього і нижнього краю з радіусом 5 нм і бічним кутом конусності 20 °. RI опори підкладки/опори встановлено на рівні n = 1,52, а конструкції оточені водою (n = 1,33). Розмір очей становив 4 нм, але його регулювали до 0,5 нм навколо дисків та травлених профілів.
Хімія поверхні
Спочатку 0,1 мМ SH-ПЕГ-метокси (5 кДа, Rapp Polymere, Німеччина) розчиняли в етанолі при 50 ° С. Субстрати занурювали в розчин ПЕГ на ніч і потім прикріплювали до мікрофлюїдних структур PDMS за допомогою низькотемпературного теплового зв’язку ( 40 ° C) протягом 2-3 годин. Імуноглобуліни анти-ПЕГ Gs (IgG) E11 та E6.3 поглинали у 50% гліцерині у концентрації 400 мкг мл-1 (посилання 36). Нейтравідин (NTV; ThermoFischer Scientific) розчиняли у відповідному буфері (ах) до концентрації 50 мкг мл-1 і використовували як такий.
Результати і обговорення
Ми використали добре встановлений, недорогий і масштабований метод колоїдної літографії 37 для створення чітко визначених візерунків золотого нанодіска короткого діапазону на стандартних предметних стеклах мікроскопа. Відповідні етапи виготовлення схематично показані на рисунках 2a - 2f, де ми також включили необов’язковий етап (малюнок 2d) двовимірного мікровибірки на основі методу, що не піднімається, розробленого Andersson et al. 38. Цей виробничий протокол забезпечує зразки, повністю сумісні з мікрофлюїдними пристроями та протоколи випробувань, раніше розроблені Aćimović та співавт. 32. Контраст між областями наночастинок та нечастинок, який можна досягти цим методом, є чудовим, як показано на додатковому малюнку.
Нанодискові підкладки забезпечують вихідну точку для вологого травлення (рис. 2g) для утворення нанодисків на вузьких стовпах, як повідомляють Otte et al. 29. Ми використовуємо стандартний буферний оксидний травлення (BOE, 15% плавикова кислота). Після обережного промивання водою, щоб зупинити процес травлення, зразки сушать під струменем азоту. Поверхневий натяг, який виникає внаслідок відступу тонкого водного шару під час сушіння, може призвести до руйнування нанопіллів, і цей ефект встановлює межу щодо того, наскільки тонкою може бути наноколонка, що в свою чергу обмежує мінімальний діаметр нанодиска, необхідний для досягнення розділення ЕМ. З цієї причини ми зосередилися на золотих нанодисках із більшим діаметром d, ніж ми розглядали раніше 29 .
На малюнку 3 узагальнено морфологічні зміни в порівнянні з часом травлення для трьох різних зразків нанодиска Au з d = 170–290 нм. Ми припустили, що швидкість травлення може бути анізотропною через тривимірний наноструктурований ландшафт. Щоб перевірити цю можливість, ми спочатку визначили швидкість вертикального травлення, скануючи профілометром через межі з нанодисками d = 290 нм. Як видно на малюнку 3а, ці дані чудово узгоджуються з відомою номінальною швидкістю травлення скла в BOE у нашій лабораторії (
90 нм хв-1). Потім ми зобразили підкладки за допомогою скануючого електронного мікроскопа (SEM) під кутом нахилу 70 °, щоб оцінити глибину бічного травлення безпосередньо під нанодисками, отриману як (d - d ′)/2, де d ′ - діаметр найближчої до нанодиска нанопильника. Дані на малюнку 3а вказують на бічну швидкість травлення 77,5 нм хв-1 (лінійне прилягання), що демонструє значну, але сприятливу анізотропію травлення, ймовірно, через дифузійну неоднорідність. Нарешті, на основі аналізу зображень за допомогою SEM, ми оцінили мінімальний механічно стабільний діаметр наностолби при d 50 нм. Малюнок 3b порівнює нетравлені диски (ліворуч) і диски, що підтримуються наноступами d = 50 нм (праворуч).
Створення нанопіллів під золотистими нанодисками шляхом офорту в BOE. a ) Вертикальна (червоні точки даних) та бічна (чорні точки) глибина травлення скла для підкладок, покритих золотими нанодисками різного діаметру d. Номінальна швидкість травлення прибл. 90 нм хв-1 позначається пунктиром. Смужки помилок представляють стандартне відхилення наборів даних. ( b ) СЕМ-зображення під кутом нахилу 70 ° репрезентативних популяцій немодифікованих та витравлених золотих нанодисків різного діаметру d (шкала масштабу = 100 нм).
Повнорозмірне зображення
Повнорозмірне зображення
Ми провели електродинамічні розрахунки, використовуючи метод FDTD, щоб обґрунтувати нашу претензію до відділу ЕМ та краще зрозуміти оптимальні параметри структури. Ми розрахували оптичну характеристику для окремих нанодисків з діаметром d = 172, 200 та 280 нм, які тісно відповідають експериментальним значенням, але ми припустили ізотропну динаміку травлення, щоб скоротити час обчислень та зусилля моделювання. Як підсумовано на малюнку 4c, розраховані позиції піків демонструють подібну експоненціальну тенденцію, як тенденція, що спостерігається в експериментах. Ширина лінії LSPR також показує експоненціальний розпад (рис. 4в, вставка), хоча експерименти показали лише загальне зменшення повної ширини до половини максимуму, ймовірно, через неоднорідне розширення, наприклад, від розміру полідисперсності кульки ПС (рис. 4b, вставка). Розрахунки показують, що резонансні плоскогір’я не є повністю рівними, частково через передбачуване ізотропне та не анізотропне травлення, але з часом мають дуже низькі схили. Ми перевірили визначення резонансного положення як функції глибини травлення, щоб визначити найвищий ступінь відшарування ЕМ, досягнутий для обраного мінімального діаметра нанопілярного стовпа d = 50 нм (рис. 4г). Дані показують, що мінімальне абсолютне значення,
0, 12 нм на нм товщини адсорбованого шару отримують для дисків 200 нм. Початкові похідні при нульовій глибині травлення представляють реакцію дисків на нескінченно тонкий шар з RI = 1,52, сформованим на склі. Для диска на 200 нм це значення становить
У 40 разів більше значення похідної для того самого диска, що підтримується стовпцем d = 50 нм. Таким чином, нанодиск істотно відокремлений від підкладки для оптимально витравленої структури. Рисунок 4e ілюструє відповідні зміни інтенсивності ЕМ ближнього поля при резонансі для цих двох граничних випадків, що вказує на значне зменшення просторового перекриття між підкладкою та підкладкою для нанодиска, що підтримується колоною.
Щоб продемонструвати перевагу роз'єднання ЕМ для застосувань біосенсорів, ми вирішили працювати з простою модельною системою, що нагадує ідеальну стратегію тестування, як показано на малюнках 1b і 1c. Ми використовуємо НТВ як пасиваційну структуру через майже незворотну адсорбцію на склі при нейтральному рН 40. Рецептор являє собою 5 кДа тіол-ПЕГ-метокси, який зв'язується виключно із золотом та ефективно відбиває білки 41, задовольняючи тим самим вимогу щодо низького перехресного забруднення між пасивуючими видами та біорекогенним шаром рецептора. Спочатку ми дослідили реакцію LSPR нанодисків, покритих ПЕГ, на НТВ (50 мкг мл-1), що, як очікується, зв’язується майже виключно зі скляною підкладкою. На малюнку 5а узагальнено відповідь після ін’єкції НТВ з дисками 210 нм, підданими травленню 0, 10, 30 і 50 с в BOE. Для найдовшого часу травлення, який значно коротший за 65 с, граничного значення для дисків 210 нм, відгук зменшується приблизно на порядок порівняно з нерозв'язаним корпусом (див. Вставку на малюнку 5а для абсолютного зсуву піків). значення).
Повнорозмірне зображення
25%. Таким чином, ми можемо зробити висновок, що всі основні характеристики зондування нанодіскових LSPR-датчиків покращуються за допомогою роз'єднання ЕМ, як підсумовано у вставці на малюнку 5b.
Сумісність підтримуваних стовпів дисків із процесом перехресного вирівнювання та об'єднання в мікрожидкостний інтерфейс PDMS у великих масштабах. a ) Частина пристрою, де 64 глянсові квадрати (у проходах між каналами та плазмонічним субстратом мікропатії) представляють 64 точки сканування. Ці місця використовувались для перевірки часу дискретизації та незалежності від шуму кількості місць сканування (дані не відображаються). На вкладці показано пристрій (24 × 24 × 5 мм) поруч із монетою (1 шведський крон). ( b ) Сенсограма в режимі реального часу, що порівнює взаємодію двох типів анти-ПЕГ IgG як функцію концентрації антитіл.
Повнорозмірне зображення
висновки
- Смачна закваска, тістечка, рецепт
- Відмінні капустяні відбивні - ідеальна їжа під час карантину Вам потрібні лише 4 основні інгредієнти та
- Відмінні котлети в томатному соусі, топ РЕЦЕПТ Гарна кухня
- Смачні сирні безглютенові ньоккі для солодкого з інжировим соусом - Fitshaker
- Прекрасні властивості меду, всемогутнього проти хвороб, та засобу, що дозволяє жити добре та здорово