реферат
МЕТА: Щоб дослідити, чи спостерігаються також покращення факторів серцево-судинного ризику, як це спостерігається в умовах енергетичного балансу після обміну вуглеводнів (CHO) для мононенасичених (MUFA) жирів, в умовах, обмежених енергією.
ДИЗАЙН: Довготривале дослідження клінічного втручання з використанням двох типів дієт з обмеженим енергоспоживанням (-30% від початкового споживання енергії) з однаковими рівнями насичених та поліненасичених жирів: дієта з високим вмістом СНО (55% енергії СНО, 10% MUFA) та дієта з високим вмістом MUFA ( 40% енергії від CHO, 25% від MUFA).
ТЕМИ: Всього 32 пацієнти із зайвою вагою (дев'ять чоловіків, 23 жінки, ІМТ: 26-45 кг/м2).
ВИМІРЮВАННЯ: Масу тіла, ліпіди в сироватці крові, інсулін у плазмі натще і фосфоліпідні жирні кислоти у складі червоних кров’яних клітин вимірювали на початковому рівні та через 8 тижнів. У ці моменти часу також вимірювали різні параметри окисного стану (гідропероксиди ліпідів плазми, загальний вміст антиоксидантів плазми крові, сечова кислота та вітамін Е) та проліферація клітин гладком'язових клітин сироватки (SMC).
Предмети та методи
предметів
Загалом 52 пацієнти з індексом маси тіла (ІМТ, кг/м2)> 25 були прийняті з амбулаторного відділення відділу метаболічних захворювань в університетській лікарні Монпельє після отримання поінформованої згоди. Жоден із пацієнтів не страждав на цукровий діабет, захворювання нирок або печінки та не приймав ліки, які могли вплинути на ліпідний обмін. Загалом було вилучено 18 пацієнтів (дев'ять з високим вмістом вуглеводів та дев'ять з дієтою з високим вмістом MUFA), оскільки з особистих чи професійних причин вони не змогли або не бажали продовжувати протокол до останнього візиту. Двох виключили з дослідження, оскільки вони мали інтеркурентну хворобу. Загалом 32 пацієнти (дев'ять чоловіків та 23 жінки) завершили дослідження дієтичного втручання. Дослідження проводилось відповідно до Гельсінської декларації 1964 року.
Вивчати дизайн
Лабораторний аналіз
Ступінь окиснення оцінювали шляхом вимірювання гідропероксидів ліпідів у плазмі, загальної плазмової антиоксидантної здатності, як ліпідів (вітамін Е), так і розчинного антиоксиданту плазми (сечової кислоти). Вітамін Е вимірювали за допомогою ВЕРХ, використовуючи зворотну фазу С18 та ізократичне елюювання метанолом. 18 Сечову кислоту вимірювали методом урикази (Orthoclinical Diagnostic, Іссі-ле-Муліно, Франція). 19 Ліпідні гідропероксиди плазми вимірювали за допомогою колориметричного методу, що дозволяє проводити селективне вимірювання гідропероксидів ліпідів у присутності перекису водню. Ця процедура, також звана FOX2, вимірює окислення залізного заліза до заліза за допомогою гідропероксидів з кількісною оцінкою заліза за допомогою комплексоутворення з ксиленоловим помаранчевим барвником та виявлення утворюється хромофору при 560 нм. Різниця між обробленими трифенилфосфіном зразками плазми для селективного відновлення гідропероксидів та необробленою плазмою є мірою справжніх гідропероксидів ліпідів за умови дотримання стандартних умов.
Антиоксидантну здатність плазми оцінювали за її здатністю відновлювати залізо (FRAP), де розвиток інтенсивного синього кольору в результаті перетворення Fe (III) -2,4,6-Tri (2-піридил) s -триазину (TPTZ ) комплекс з Fe (II)) -TTPZ безпосередньо пов'язаний із кількістю присутнього відновника. Значення несечової кислоти Значення FRAP розраховували шляхом віднімання частки сечової кислоти (виміряної концентрації сечової кислоти в мкмоль/л × 2) із загальної антиоксидантної здатності.
Культура клітин гладких м’язів
Проліферацію SMC вимірювали на сироватці, що зберігалася при -80 ° C до аналізу. Зразки з тих самих суб'єктів (до і після дослідження втручання) тестували в тому ж аналітичному циклі.
Клітини гладкої мускулатури аорти виділяли від самців щурів Wistar, як описано вище. Клітини інкубували в DMEM/F-10 (Eurobio, Франція) з доповненням 10% фетальної телячої сироватки, 2 ммоль/л L-глутаміну, 25 ммоль/л HEPES, 100 ОД/мл пеніциліну, 100 мкг/мл стрептоміцину при 37 ° C ° C у зволоженій атмосфері 5% CO 2/95% повітря. Клітини ідентифікували як гладкі м’язи за наявністю активного актину гладких м’язів. У місці злиття клітини відокремлювали трипсином-ЕДТА і пересівали. У цьому дослідженні використовували клітини з проходів від трьох до шести. Для експериментів клітини висівали в 24-лункові планшети при 40 х 103 клітин/лунку. Через 24 години клітини інкубували в безсироватковому середовищі, що містить інсулін (1 мкмоль/л, Sigma), трансферин (200 мкг/мл, Sigma), аскорбат (0,2 ммоль/l, Sigma) та селеніт натрію (6,25 нг/мл). Sigma) 48 годин для синхронізації на етапі G0. Потім клітини замінювали середовищем, що містить сироватку (5%) від досліджуваних. ЗМІ одного разу змінилися. Через 5 днів клітини збирали за допомогою трипсину-ЕДТА, фіксували у 4% формаліні та підраховували на комп’ютері Колтера (Epics XL, Франція).
Статистичний аналіз
результат
Дотримання дієти
У таблиці 2 показано щоденне споживання їжі для кожного типу дієти. Зразки заявок, описані в цій таблиці, є однією із семи заявок, які змінювались протягом 8-тижневого періоду втручання до рівня енергії 7,6 МДж/день. Було зафіксовано задовільне споживання енергії, хоч і трохи нижче від встановленого. Споживання їжі (табл. 3) показало, що відсотки енергії від загальних жирів, СНО та MUFA суттєво відрізнялись (насичені жирні кислоти P 24 або з різним вивільненням насичених жирів із жирової тканини під час схуднення.
Стіл в натуральну величину
Стіл в натуральну величину
Стіл в натуральну величину
Втрата ваги
Втрата ваги становила -4,4 ± 0,6 кг на 4 тижні та -6,7 ± 0,7 кг на 8 тижні при середній початковій масі тіла 95 ± 3 кг. Не було статистично значущої різниці між групами дієт, незалежно від моменту часу після коригування початкової маси тіла. Втрата ФМ на одиницю втрати ваги становила 0,70, що свідчить про те, що втрата ваги була досягнута приблизно на 2/3 за рахунок ФМ, а решта 1/3 за рахунок м’язової маси, включаючи м’язи та воду. На це співвідношення не впливав склад раціону. Наприкінці періоду дієти спостерігалося значне зменшення окружності талії (P 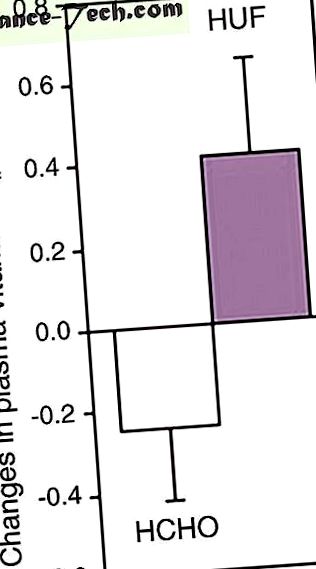
Середні (± sem) зміни нормалізованого вітаміну Е в плазмі після 8 тижнів обмеження енергії (-30% від початкового споживання енергії) при двох різних дієтах: HCHO () дієта з високим вмістом вуглеводів (n = 15); та HUF (
Повнорозмірне зображення
Поширення SMC
Порівняно з початковим рівнем, проліферація значно зросла після дієти HCHO (+8,9 ± 4,5%, P = 0,024), але залишилася незмінною після дієти HUF (рис.2). Відносні зміни в проліферації SMC (%) негативно корелювали зі змінами холестерину ЛПВЩ (r =, 0,37, P = 0,042). У регресійній моделі зміни в проліферації SMC були негативно пов'язані зі змінами відношення олеїнової кислоти до лінолевої кислоти незалежно від змін рівня холестерину ЛПВЩ (табл. 7).
Середні (± sem) відносні зміни в проліферації гладком’язових клітин (SMC) (%) через 8 тижнів обмеження енергії (-30% від початкового споживання енергії) при двох різних дієтах: HCHO () дієта з високим вмістом вуглеводів (n = 15); та HUF (
Повнорозмірне зображення
Стіл в натуральну величину
обговорення
Метою цього дослідження було з'ясувати вплив дієтичних MUFA на втрату ваги, вміст ліпідів у сироватці крові, концентрацію плазми натще, рівень антиоксиданту та індуковану сироваткою SMC у осіб із надмірною вагою протягом короткого періоду (8 тижнів) активної ваги. шари.
Наведені результати показують, що зменшення споживання енергії мало такий самий вплив на втрату ваги, коли MUFA замінювали жирами CHO без зміни концентрацій SFA та PUFA. Відсутність впливу вмісту макроелементів на дієти зі зниженою енергією на втрату ваги також повідомлялося в короткострокових експериментах зі зниженням ваги. 26, 27, 28, 29, 30
Втрата ваги та харчовий склад жиру можуть впливати на розповсюдження СМС, що є важливою подією у розвитку атеросклерозу. Mata et al. 36 показали, що збагачені MUFA дієти зменшують синтез ДНК в SMC, але не вимірюють проліферацію клітин. Наші результати вперше чітко показали, що реакція індукованої сироваткою крові проліферації на втрату ваги залежала від складу дієти: збагачена MUFA дієта запобігала збільшенню проліферації, як це спостерігається при дієті HCHO. Крім того, зміни в проліферації SMC негативно пов’язані із змінами співвідношення олеїнової кислоти до лінолевої кислоти незалежно від змін рівня холестерину ЛПВЩ. Однак посилене розповсюдження в дієті HCHO було несподіваним. Поліпшення обміну ліпідів та глюкози повинно зменшити сприйнятливість до проліферації, оскільки ЛПВЩ, антагоніст окисленого ЛПНЩ при атеросклерозі, не зменшився після дієт у цій групі. Ми припускаємо, що зміни рівня олеїнової кислоти або співвідношення олеїнової кислоти до лінолевої кислоти, як це спостерігається при фосфоліпідах мембрани еритроцитів, швидше за все відбуватимуться в ліпопротеїнах плазми крові та можуть мати сильний регуляторний вплив на проліферацію СМС.
На закінчення ми показали, що під час цієї 8-тижневої спроби схуднення зменшення споживання енергії на 30% за допомогою MUFA або CHO вплинуло на втрату ваги, рівень холестерину в сироватці крові та інсулін натще. Однак навіть за цих умов обмеження енергії дієта, багата MUFA, мала кращий вплив на концентрацію TG у сироватці крові, ніж дієта, багата CHO, що припускає, що дієти, багаті MUFA, можуть мати довгострокові переваги для серцево-судинної системи. Крім того, зміни концентрації вітаміну Е у плазмі крові та індукована сироваткою крові проліферація SMC узгоджувались із захисною дією олеїнової кислоти на окислювальний стан та проліферацію SMC, тобто на серцево-судинний ризик. Таким чином, поєднання втрати ваги та зниження насичених жирів до реального відсотка 10%, як було досягнуто в цьому дослідженні, залишає можливість модулювати розподіл між CHO та MUFA відповідно до переваг пацієнта, метаболічного профілю та харчових цілей, але MUFA споживання.
- Любіть ріпакову олію! Жири в харчуванні жінок і чоловіків
- Любіть ріпакову олію! Жири в раціоні людей, які страждають на проблеми зі щитовидною залозою та діабет
- Цинк - ефекти, дефіцит цинку, дозування
- Все про зміцнення, дієту, графіки тренувань
- Касторова олія як рятувальник волосся. Які його наслідки?
