Rev Méd Чилі 2007; 135: 631-635
КЛІНІЧНІ СПРАВИ
Синдром дефіциту транспортера глюкози типу 1 (SDGLUT-1), який лікується кетогенною дієтою. Клінічний випадок
Тип транспонування глюкози 7 дефіцитний синдром (GLUT-1 SD), який лікується кетогенною дієтою. Звіт про одну справу
Verónica Cornejo E 1a, Juan Francisco Cabello A 1, Marta Colombo C 2, Erna Raimann B 1 .
1 Лабораторія метаболічних хвороб, Інститут харчування та харчових технологій (INTA), Університет Чилі, 2 Лабораторія метаболічних захворювань, лікарня Ван Бурен, Вальпараїсо.
дієтолог, магістр людського харчування
(Ключові слова: Хвороби головного мозку, метаболічні, вроджені; Транспортер глюкози тип 1; Судоми)
І У 1991 р. De Vivo описав синдром дефіциту церебрального транспортера глюкози 1 типу (SDGLUT-1) (OMIM 606777) у двох пацієнтів, у яких спостерігалася епілептична енцефалопатія, яка розвинулася із затримкою психомоторного розвитку, зупинкою росту черепа, мікроцефалією, порушенням координації та спастичністю . Крім того, він виявив зниження рівня глюкози та лактату в спинномозковій рідині, але не виявив гіпоглікемії 1 .
SDGLUT-1 має аутосомно-домінантне успадкування 2. Транспортер Glut-1 - це глікопротеїн, що складається з 492 амінокислот, відповідальних за транспортування глюкози через гематоенцефалічний бар’єр, що експресується в ендотеліальних клітинах судин, астроцитах та нейронах. Ген був закодований на короткому плечі хромосоми 1 (p34.2) і складається з 10 екзонів та 9 інтронів. На сьогодні описано понад 30 мутацій. Показано, що концентрація Glutl і Glut3 є низькою при народженні та нормалізується при відлученні від грудей - період, що відповідає підвищеному зростанню та дозріванню. Деякі автори показали, що цей глікопротеїн інгібується фенобарбіталом 3 .
Пре- та перинатальний анамнез дитини, ураженої цією патологією, мабуть, нормальний до 2-місячного віку, коли з’являються епізоди апное та рухи очей типу опсоклонус, які можуть передувати епілептичним припадкам. Дитячі напади клінічно фрагментовані, ЕЕГ демонструє мультифокальні виділення, а також описані генералізовані тонічні типи, міоклонія, атипова відсутність, атонічні та некласифіковані. Частота може бути щоденною, випадковою або без судом 4. Ці напади не реагують на протисудомні засоби. Також можуть бути виявлені неепілептичні нападоподібні явища, такі як періодична атаксія, психічна розгубленість, млявість, сонливість, геміпарез, ненормальні рухи, параліч, порушення сну, мікроцефалія або уповільнення росту черепа 5. .
У лабораторних тестах спостерігається стійка гіпогліконія (нижче 40 мг/дл), лактат у лікворі може зменшуватися або не знижуватися (6 .
Лікування ґрунтується на кетогенній дієті, яка забезпечить необхідну енергію мозку через кетонові тіла. Через великі обмеження природних продуктів, багатих вуглеводами, які, в свою чергу, є джерелом необхідних поживних речовин, дієта повинна постійно поповнюватися мінералами, ліпо та водорозчинними вітамінами, L-карнітином та ліпоєвою кислотою відповідно до віку та статі. 7-10 .
Ми описуємо клініку, біохімію, молекулярні дослідження та довгострокове спостереження за першим випадком SDGLUT-1, діагностованим у Чилі.
Клінічний випадок
Пацієнтка, батьки, що не є спорідненими, без відповідного перинатального анамнезу; вага при народженні 3-450 г, зріст 49,5 см, а окружність черепа 35,2 см. Апгар 9, через 5 хв.
У півторамісячному віці він представив генералізовані тонічні клонічні напади, що тривали секунди, розвиваючись із 20 міоклонусами на день, додаючи спазми згинання. Вона отримувала фармакологічне лікування вальпроєвою кислотою, фенобарбіталом та карбамазепіном без клінічної відповіді, що викликало побічну реакцію на вальпроєву кислоту із симптоматичною гіперамонемією.
У віці 3 з половиною місяців проводили тести для виключення метаболічного захворювання, виявляючи лактацидемію 26,5 мг/дл (VN: 5-15), зменшення вмісту лактату ліквору в 5,6 мг/дл (VN: 10,8 -18,9 мг/дл). Піровиноградна кислота в плазмі крові була підвищена (1,4 мг/дл) (VN: 0,3-0,9), але в лікворі це було нормально (0,43 мг/дл) (VN: 0,5-1,7), а аміак - 85 мкг/дл (35-100 мкг/дл). Кількісне визначення амінокислот у сироватці крові, ацилкарнінів у цільній крові, органічних кислот у сечі та карнітину у сироватці крові було нормальним.
Через 5 місяців електроенцефалограма (ЕЕГ) виявила безперервну поліморфну тета-дельта-активність, яку вважали ненормальною для віку, а магнітно-резонансна томографія показала фронтальну атрофію зі збільшенням субарахноїдальних просторів. Він еволюціонував із затримкою психомоторного розвитку та уповільненням росту черепа, атаксією стовбура та двостороннім пірамідним синдромом.
Через 7 місяців він потрапив до Бостонської дитячої лікарні, Сполучені Штати Америки, де було виявлено зниження рівня глюкози в лікворі на 26 мг/дл та нормоглікемії (84 мг/дл), отримавши співвідношення між обома параметрами 0, 31 (нормальне значення понад 0,65 + 0,01), що відповідає гіпоглікорахії, що передбачає SDGLUT-1.
Показано, що білок Glut-1 в еритроцитах ідентичний білку Glut-1 ендотеліальних клітин капілярів мозку як за імунною, так і за хімічною реакцією. З цієї причини транспорт глюкози в еритроцитах порівнянний з транспортом глюкози через гематоенцефалічний бар’єр. Враховуючи цю знахідку, була розроблена методика 3-O-метил D глюкози, яка визначає поглинання глюкози еритроцитами, дозволяючи екстраполяцію з транспортом глюкози в гематоенцефалічному бар'єрі 11. У нашому випадку застосовували цю методику, отримуючи поглинання глюкози 44% (VN 80% -100%), підтверджуючи SDGLUT-1.
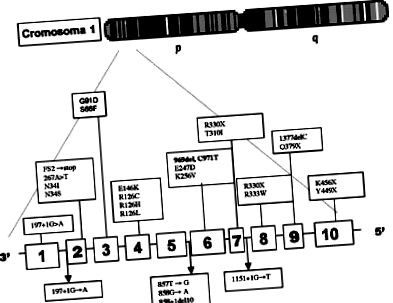
У молекулярному дослідженні використовували ланцюгову реакцію полімерази (ПЛР) та аналіз поліморфізмів рестрикційних фрагментів (RFLP) 3,6, визначаючи мутацію групи делеції 969, C971T, розташованої в екзоні 6, гена Glut. 1 (рисунок 1) (Молекулярне дослідження, проведене д-ром Д. Де Віво).
Комп’ютерна томографія з однофотонною емісією (ОФЕКТ) показала двосторонній скроневий, лівий тім’яний та таламічний гіпометаболізм.
Кетогенна дієта була розпочата негайно, забезпечуючи 90 калорій на кілограм ваги, з 85% ліпідів, 9% білків і 6% вуглеводів, із співвідношенням 3: 1 між ліпідами та білками плюс вуглеводи, на основі протоколу, що використовується в INTA, від Чилійський університет 9,10. Дієта забороняє обмежувати вживання продуктів із сахарозою, сорбітом, фруктозою та лактозою, саме тому необхідно було вживати кальцій (450 мг/день), цинк (5 мг/день), вітаміни, особливо вітамін С (1 г/день) для запобігання клітинному окисленню, L-карнітин (50 мг/кг/день) та ліпоєва кислота (200 мг/день).
Через 7 днів після початку кетогенної дієти напади зникли, і спільно почалося зменшення протисудомних препаратів.
На сьогоднішній день 6 років, він підтримує кетогенну дієту з 83% ліпідів (27% з них відповідають тригліцеридам із середньою ланцюгом) та 17% білків та вуглеводів (співвідношення 2,5: 1). Добавки поживних речовин такі ж, як і на початку, і їх адаптували відповідно до віку та стану харчування.
Глікемія залишається на рівні від 80 до 90 мг/дл, загального холестерину - 187 мг/дл, ЛПВЩ - 55 мг/дл, а ЛПНЩ - 121 мг/дл. Кальціурія, креатинінурія, біохімічний профіль, венозні гази та плазмові електроліти знаходяться в межах норми. Бета-гідроксибутиратна кислота натще становить 2,5 мкМ/1, а після їжі - 5,0 мкМ/л, враховуючи кетогенез, коли це значення перевищує 2,0 мкМ/1.
При неврологічному обстеженні гіперактивна поведінка виділяється при його психічному обстеженні. У черепно-мозкових нервах він представляє дизартрію та гіпомімію обличчя. Рухове обстеження показує зниження тонусу тулуба і кінцівок без порушення компромісів у силі або м’язовій трофіці. При огляді мозочка спостерігається дрібний тремор наміру, наявність синкінезу, дисметрії та дискретного дисдіадохокінезу. Хода нестійка і характеризується збільшенням основи опори, без латералізації.
Його коефіцієнт інтелекту (IQ), оцінений тестом інтелекту Wechs-ler для дошкільнят (WISP) 12, отримав загальний коефіцієнт інтелекту в 103 бали, верхню межу середнього діапазону норм, виправлену відповідно до північноамериканських стандартів. Однак він представляє значну розбіжність між вербальною та ручною шкалою на шкоду останній (словесний IQ: 119, високий нормальний та ручний IQ: 85, повільний нормальний), що обертається особливими труднощами в зорово-просторовій організації та візомоторному.
Харчовий статус нормальний: індекс маси тіла 15,8 кг/м 2 (VN від 15 до 18 кг/м 2) 13, з вагою (21 кг) для віку та зростом (1,16 м) для віку, обидва параметри при 75-й процентиль довідкової таблиці (Національний центр статистики охорони здоров’я) 14 .
З 1991 р. По сьогодні в світі діагностували близько 100 випадків за всіма клінічними проявами 15 .
Більшість випадків, описаних у літературі, мали нормальний анамнез до і до перинатального періоду, і першим клінічним проявом були судоми протягом перших 4 місяців життя, без відповіді на протисудомне лікування. Також спостерігалося зниження глюкози та лактату в лікворі, рівне тому, що було виявлено в нашому випадку. Однак диференціальний діагноз поширився на інші клінічні симптоми, оскільки він був описаний у дітей, які мали лише ненормальні рухи очей і у яких спочатку підозрювали приховану нейробластому. Тому пропонується, щоб у будь-якої дитини із суперечливою клінічною картиною та нормальним вмістом глюкози в крові оцінювали значення глюкози у лікворі, щоб виключити GLUT-1 .
Іншим важливим моментом є позитивна реакція на кетогенну дієту, яка пригнічує судоми. Кетонові тіла потрапляють в мозок через монотрикарбоновий транспортер, що використовується жирними кислотами із середнім ланцюгом, які метаболізуються виключно в матриці мітохондрій до ацетил-КоА, перетворюючи цей субстрат в єдине мозкове паливо. У представленому клінічному випадку кетогенна дієта була розпочата у віці 7 місяців, і напади негайно припинились. На сьогоднішній день він дотримується цієї дієти і не повторював судом 8 .
Кетогенна дієта зазвичай використовується при тугоплавкій епілепсії, показуючи, що вона діє як природний протисудомний засіб, пов’язуючи цей ефект із наявністю бета-гідроксибутиратної кислоти. Кілька досліджень показали, що його тривале застосування не викликає розладів у вазі 16,19. У нашому випадку кетогенна дієта має співвідношення між ліпідами та білками та вуглеводами 3: 1, вона була адаптована до харчових потреб відповідно до віку та ваги, підкреслюючи задоволення потреб у вітамінах та мінералах. Після майже 6 років спостереження пацієнт має нормальний ріст, спостерігаючи вагу та зріст у 75 процентилях, ХМЛ 15,8 кг/м 2, у межах норми для її віку.
Усі описані випадки мають певні когнітивні порушення, які варіюються від інвалідності до навчання до важкої розумової відсталості. Крім того, спостерігаються мовні зміни, що описують дизартрію, із зміною експресивної та сприйнятливої мови 1 5. Наш випадок має нормальний когнітивний розвиток із загальним коефіцієнтом інтелекту 103 і словесним коефіцієнтом інтелекту 119, останні класифікуються у діапазоні високих норм, що відрізняється від того, що зустрічається в літературі. Це можна пояснити двома причинами: одна з них - вік діагнозу, оскільки більшість описаних пацієнтів були виявлені пізно. Інший полягає в тому, що деякі мутації типу відсутності або видалення були пов’язані з помірною клінічною формою. Запропонована кореляція генотип/фенотип є гіпотезою, яка вимагає підтвердження більшої кількості випадків. Крім того, мутація, виявлена в нашому випадку, не була описана в іншій родині 3,20 .
ЛІТЕРАТУРА
1. De Vivo D, Trifiletti R, Jacobson R, Roñen G, Behmand R, Heik S. Дефектний транспорт глюкози через гематоенцефалічний бамер як причину стійкої гіпоглікорагії, судом та затримки розвитку. N Engl J Med. 1991; 325: 703-9. [Посилання]
2. Wang D, Brockmann K, Korenke CG, Von Moers A, Ho YY, Pascual JM et al. Синдром дефіциту Glut-1: аутосомна передача домінату мутації міссенсу R126H. Енн Нейрол. 2001; 50: S124. [Посилання]
3. Ванг Д., Паскуаль Дж., Ян Ч., Енгельстад К., Джунг С., Пенг Сун Р, Де-Віво Д. Синдром дефіциту глута-1: клінічні, генетичні та терапевтичні аспекти. Енн Нейрол. 2005 рік; 57: 111-18. [Посилання]
4. Фон Моерс А, Брокман К, Ванг Д, Коренке К.Г., Хупке Р, Девіво, DC, Ханефельд Ф. Особливості ЕЕГ із синдромом дефіциту глута-1. Епілепсія. 2002; 43: 941-5. [Посилання]
5. Pascual J, Wang D, Lecumberri B, Yang H, Mao X, Yang R, De Vivo D. Дефіцит GLUT1 та інші захворювання транспортера глюкози. Eur J Ендокринол. 2004; 150: 627-33. [Посилання]
6. Pascual J, Van Heerttum R, Wang D, Engelstad K, De Vivo D. Візуалізація метаболічного сліду дефіциту Glutl в мозку. Енн Нейрол. 2002; 52: 458-64. [Посилання]
7. Акоста П. Дефект білка, що транспортує глюкозу, дефіцит комплексу піруват-дегідрогенази та нерозв'язні напади. У: Акоста П, Янічеллі С., ред. Протоколи підтримки харчування: Редакційна лабораторія Abbott, 2001; 279-95. [Посилання]
8. Klepper J, Diefenbach S, Kohlschütter A, Voit T. Вплив кетогенної дієти на синдром дефіциту транспортера глюкози 1. Простаглан-дини Лейкот Ессент жирні кислоти. 2004; 70: 321-7. [Посилання]
9. Кизил В. Кетогенна дієта при лікуванні рефрактерної епілепсії. Преподобний ChilNutr. 2000; 27: 326-31. [Посилання]
10. Кизил В. Кетогенна дієта в педіатрії. В: Sanjurjo P, Baldellou A, eds. Діагностика та лікування спадкових метаболічних захворювань: Редакція Ergon SA, Мадрид, Іспанія, 2001; 111-120. [Посилання]
11. Клеппер Дж, Гарсія Альварес М, О'Дрісколл К, Парідес М, Ванг Д, Юань ХО Y, Де Віво DC. Еритроцити 3-0. аналіз поглинання глюкози метил-D для діагностики транспортно-білкового синдрому глюкози. J Clin Lab Anal. 1999; 13: 116-21. [Посилання]
12. Wechsler D. Посібник для інтелектуальної шкали Wechsler для дітей, переглянутий. Сан-Антоніо, штат Техас: Редакція психологічної корпорації, Harcourt Brace Jovanovich, Inc. 1974 р. [Посилання]
13. Кучмарський Р, Огден С, Груммер-Сороун Л. Графіки зростання CDC: США. Розширені дані статистики життєво важливих ситуацій та стану здоров'я;№ 314. Хаятсвілль, штат Меріленд: Редакційний національний центр статистики охорони здоров’я 2000. [Посилання]
14. Villalabos N, Vergara A, Jara C, Orellana N, Maggi A, Torres M, González I. Амбулаторне лікування недоїдання через дефіцит та надлишок у дітей до 6 років. Міністерство охорони здоров'я, уряд Чилі 2005: 7-14. [Посилання]
15. Гордон Н, Ньютон Р. Дефіцит транспортера глюкози типу 1 (GLUT-1). Brain Dev.2003; 27: 477-80. [Посилання]
16. Bailey E, Pfeifer H, Thiele E. Використання дієти при лікуванні епілепсії. Епілепсія та поведінка. 2005 рік; 6: 4-8. [Посилання]
17. Vamecq J, Vallée L, Lesage F, Gressens P, Stables J. Популярна антиепілептична кетогенна дієта: нові повороти в стародавній історії. Нейробіол Prog. 2005 рік; 75: 1-28. [Посилання]
18. Couch S, Schwarzman F, Carroll J, Koenigsberger D, Nordli D, Deckelbaum R et al. Результати зростання та харчування дітей, які отримували кетогенну дієту. J Am Дієта доц. 1999; 99: 1573-5. [Посилання]
19. Liu Y, Williams S, Basualdo-Hammond C, Stephens D, Curtis R. Проспективне дослідження: ріст та харчовий статус дітей, які отримували кетогенну дієту. J Am Дієта доц. 2003; 103: 707-12. [Посилання]
20. Ванг Д, Кранц-Ебле П, Де Віво DC. Мутаційний аналіз GLUT1 (SLC2A1) при синдромі дефіциту Glut-1. Hum mutat. 2000; 16: 224-31. [Посилання]
Дякую
До Бостонської дитячої лікарні, особливо доктора Дарріла Де Віво, який провів молекулярне дослідження справи.
Отримано 9 травня 2005 р. - Прийнято 28 серпня 2006 р.
Листування: Професор Verónica Cornejo E. INTA, Університет Чилі. Box 13811, Сантьяго, Чилі. Факс: 56-2-2941254. Електронна пошта: [email protected]
Весь вміст цього журналу, крім випадків, коли він ідентифікований, підпадає під ліцензію Creative Commons
Бернарда Морін 488, Провіденсія,
Графа 168, пошта 55
Сантьяго, Чилі
Тел .: (56-2) 2753 5520