Його ще називають карбонатом натрію, карбонатом натрію, сіллю Віші або бікарбонатом натрію. Цей продукт, NaHCO 3, характеризується як білий кристалічний порошок, без запаху, із солоним смаком та злегка лужним. Розчинний у воді та практично не розчинний у спирті. На сухому повітрі він незмінний, а у вологому розкладається.
Він розчиняється в 9 частинах холодної води. Якщо цей розчин перемішати, частина бікарбонату втрачається внаслідок виділення CO 2, і те ж саме відбувається, якщо його нагрівати вище 70 ° C. Нагріта при 400 ° C ця сіль перетворюється на нейтральний карбонат із втратою приблизно 35% його первісної ваги.
Безводний карбонат натрію, широко відомий як сода Сольвей, сода для прання, содова сода або кальцинована сода, використовується у промислових кількостях для виробництва скла, мила, паперу, емалей та інших хімічних продуктів, а також для очищення жорсткої води.
Бікарбонат натрію використовується як антацид шлунку в медицині. Більша частина бікарбонату, що виробляється на промисловому рівні, використовується для його перетворення в карбонат натрію при плавному нагріванні, відповідно до реакції:
2 NaHCO 3 (s) Na 2 CO 3 (s) + H 2 O (g) + CO 2 (g)
З біологічної точки зору CO 2 і HCO 3 - відповідають за кислотний та основний запас у живих організмах.
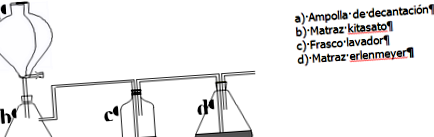
скляна лійка кітасато колба
Ампула для розсмоктування пробірки 15 мл і 100 мл
промивна пляшка 3 пробірки Ерленмайєрова колба лійка Бюхнера
100 мл склянка 1 бюретка
NaCl AgNO 3 0,5М
CaCO 3 Фенолфталеїн (FT)
NH 3 15M (комерційний) 0,1N розчину HCl
100 мл 6M HCl (Підготовлено студентами) Метиловий апельсин (NM)
Синтез NaHCO 3 на промисловому рівні здійснюється методом Сольвея, заснованим на реакції, яка відбувається між насиченим розчином хлориду натрію у водному аміаку та вуглекислим газом, з якого можна відокремити твердий бікарбонат натрію.
Сировиною є звичайна сіль (NaCl), вапняк (що складається переважно з CaCO 3), як недорогі матеріали, так і аміак, який згодом можна отримати з розчину хлориду амонію. На основі процесу Сольве ми проведемо синтез бікарбонату з наступною реакційною системою:
У першій частині системи ми збираємося виробляти CO 2, для цього ми повільно додаємо HCl над CaCO 3 .
У пляшці c миємо CO 2, що виділяється для усунення домішок. Потрапивши в колбу d, він реагує із насиченим розчином повареної солі у водному аміаку, який утворюється переважно іонами: NH 4 +, OH -, Cl - та Na + .
CO 2 реагує з водою та аміаком, утворюючи NH 4 HCO 3, який дисоціює, отримуючи моногідрогенкарбонат, який, нарешті, у насиченому розчині NaCl випадає в осад у вигляді бікарбонату натрію.
Завдяки насиченню CO 2 і часу, який він повинен відпочити для кращої кристалізації бікарбонату, його отримують не чистим, а змішаним з карбонатом натрію. З цієї причини буде оцінено та визначено відсоток кожної солі в отриманому продукті.
МЕТОД СИНТЕЗУ
Спочатку збирається реакційна система. Готують 100 мл 6М HCl; Зважують 8 г NaCl і 40 г CaCO 3 .
У вітрині комерційний NaCl поміщають у склянку та додають 20 мл комерційного аміаку. Коли практично все розчиняється, розчин фільтрується через колбу Ерленмейера плісе-фільтром.
6М HCl поміщають у розділяючий флакон (а). У колбу китасату (b) поміщають CaCO 3. Вода поміщається в пляшку для проміжного промивання (скляна трубка повинна знаходитися нижче поверхні рідини). (d) - колба Ерленмейера з насиченим розчином NaCl у водному аміаку.
Після того, як реакційну систему зібрано, ми повільно додаємо 6М HCl над CaCO 3, і виділений CO 2 барботується над розчином d протягом 30 хвилин. Залишають кристалізуватися на ніч і отриманий осад фільтрують через лійку Бюхнера; промивають 20 мл 50% етанолу, сушать на повітрі.
1. Встановіть реакції, що відбуваються в різних сферах системи збору.
В зоні с реакційної системи перевіряють значення рН до і після проходження CO 2 .
2. Опишіть зовнішній вигляд отриманого продукту
1. Розчиніть частину продукту в 5 мл води. Виміряйте рН отриманого розчину. Обґрунтуйте зазначений рН за допомогою відповідного іонного рівняння.
2. Помістіть другу порцію отриманого продукту в пробірку і нагрійте її. Вкажіть реакцію, яка має місце. Охолодити пробірку і додати 5 мл води. Виміряйте рН і порівняйте його з отриманим у 1. Напишіть іонне рівняння, яке виправдовує рН цього розчину.
3. Помістіть третю порцію продукту в пробірку і додайте 2 мл 3М HCl.Який газ виділяється? Напишіть відповідне хімічне рівняння.
4. Якщо до водного розчину бікарбонату додати AgNO 3, утворюється білий осад. Що може бути обумовлено?
ВИЗНАЧЕННЯ ПРОЦЕНТУ NaHCO 3 та Na 2 CO 3