- Резюме
- Вступ
- Результати
- Виснаження Lin-9 у клітинах мишачої ембріональної карциноми виявляє мітотичний дефект
- Lin-9 необхідний для транскрипції гена G 2/M
- Lin-9 асоціюється з B-Myb, але не з кишеньковими білками в клітинах F9
- Клітини F9 містять LINC-подібний комплекс, що містить B-Myb та Lin-9
- Lin-9 та B-Myb зв'язують та активують промотори генів G 2/M
- Конкретні сайти зв'язування на промоторі Survivin є важливими для зв'язування Lin-9 та B-Myb
- Обговорення
- Конфлікт інтересів
- Додаткова інформація
- Файли зображень
- Додаткова фігура S1
- Додаткова фігура S2
- Додаткова фігура S3
- Документи Word
- Додаткові цифри Легенда
- Додаткові матеріали та методи
- Файли Excel
- Додаткова інформація
Резюме
Вступ
У цьому дослідженні ми досліджували взаємодію Lin-9/B-Myb у клітинах ембріональної карциноми миші F9 миші, які на відміну від клітин, що раніше вивчались, регулюються лише при переході G 2/M. У клітинах F9, як і в ембріональному стовбурі мишей клітини (ES) (White et al., 2005), кишенькові білки Rb, p107 та p130 підтримуються в гіперфосфорильованому стані. Отже, у G 1/S відсутні репресивні комплекси E2F і відсутність регуляції клітинного циклу. Ми показуємо, що придушення експресії Lin-9 втручанням РНК викликає зупинку в мітозі, і ми використовуємо цю систему для виявлення транскрипційних цілей Lin-9 . Згодом було показано, що Lin-9 та B-Myb співпрацюють як активатори транскрипції ключових генів G2/M. Нарешті, ми виявили комплекс B-Myb у клітинах F9, який містить більшість компонентів, раніше визначених у LINC. Важливо зазначити, що у недиференційованих клітинах F9 не виявлено зв'язку між кишеньковими білками та LINC, що демонструє, що клітинний цикл регулюється комплексом B-Myb/LINC лише у переході G 2/M.
Результати
Виснаження Lin-9 у клітинах мишачої ембріональної карциноми виявляє мітотичний дефект
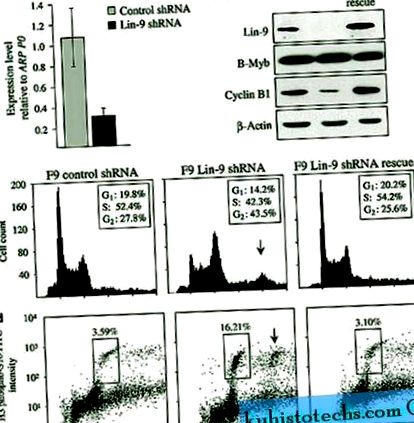
Lin-9 виснажувався з клітин F9 шляхом трансфекції векторів pSuper, що кодують коротку РНК-шпильку (shRNA), спрямовану проти мишачого Lin-9. Контрольні клітини трансфікували pSuper, експресуючи люциферазу shRNA pGL3. Кількісна ПЛР (qPCR) продемонструвала, що Lin-9 shRNA значно зменшила експресію Lin-9 на 71% (P
Виснаження Lin-9 у клітинах ембріональної карциноми F9 виявляє мітотичний дефект. ( до ) Кількісний RT-PCR-аналіз експресії Lin-9 у виснажених Lin-9 клітинах щодо контрольних клітин. Експресія нормалізувалась до рибосомного ARPP0. ( b ) Вестерн-блот-аналіз Lin-9, B-Myb та Cyclin B1 у клітинах F9, трансфікованих shRNA GL3 (контроль), shRNA Lin-9 (Lin-9) та shRNA Lin-9 з резистентним до shRNA pCAGGS-Lin - 9R вектором (порятунок). Control-актин використовували як контроль навантаження. ( c ) Проточний цитометричний аналіз (FACS) клітин, збіднених Lin-9, контроль і порятунок, пофарбовані йодидом пропідію (PI). Стрілка вказує на клітини з вмістом ДНК 8n. ( d ) FACS-аналіз збіднених Lin-9 рятувальних та контрольних клітин, забарвлених антигістоновою H3 (фосфо S10) -FITC та забруднених PI. Клітини в мітозі упаковуються в коробки, а мітотичний індекс відображається у відсотках від клітин. Стрілка вказує на клітини, що містять 8n ДНК, що зазнає мітозу.
Повнорозмірне зображення
Щоб визначити, чи виснажені клітини Lin-9 накопичуються в G 2 або мітоз, клітини аналізували за допомогою FACS та конфокальної мікроскопії. Для визначення мітотичного індексу проводили FACS з клітинами, забарвленими антитілом до фосфосерину 10 H3 фосфосерину (H3 phosphoS10), маркером мітозу (Paulson and Taylor, 1982). Виснажені клітини Lin-9 показали підвищену мітотичність (16,21%) порівняно з контрольними клітинами (3,59%) та рятувальними клітинами (3,10%; рис. 1г). Додаткову популяцію клітин, що містять 8n ДНК, спостерігали при виснаженні Lin-9, і ці клітини фарбували позитивним вмістом фосфоS10 H3, вказуючи на те, що вони перебувають у мітозі. Конфокальна мікроскопія клітин, забарвлених β-тубуліном та антитілами DAPI, показала вищу мітотичність (14,42%) у клітинах із виснаженням Lin-9 порівняно з контрольними (3,38%) та рятувальними клітинами (3,07%; додатковий малюнок S2). Збіднені клітини Lin-9 містили унікальні ядра і утворювали біполярне веретено під час мітозу, що вказує на те, що накопичення 4n і 8n клітин відбулося внаслідок відмови мітозу, а не неправильного формування веретена чи відмови цитокінезу.
Lin-9 необхідний для транскрипції гена G 2/M
Lin-9 необхідний для регуляції генів G 2/M в ембріональних стовбурових клітинах. ( до ) Таблиця генів G 2/M, що регулюються вниз у виснажених Lin-9 ембріональних клітинах F9, як визначено за допомогою аналізу мікрочипів кДНК. Рівні експресії Lin-9 знижувались у виснажених Lin-9 клітинах F9. ( b ) Кількісний RT-PCR-аналіз генів-мішеней Lin-9 у виснажених клітинах Lin-9 щодо контрольних клітин для перевірки даних мікрочипів. Вираз нормалізували до ARRP0 .
Повнорозмірне зображення
Зниження регуляції різних генів G 2/M у виснажених клітинах Lin-9 було незалежно підтверджено qPCR (рис. 2b). Важливо зазначити, що експресія регульованих генів на інших стадіях клітинного циклу не зменшувалася; Циклін E2, який необхідний для переходу G 1/S, регулювався вгору, тоді як B-Myb, експресія якого досягла максимуму під час S-фази, не зазнала змін (рис. 2b). Цікаво, що експресія цикліну А2 та Cdc2 не була суттєво модифікована виснаженням Lin-9 у клітинах F9, хоча попередні дослідження на клітинах дорослих показали транскрипційну залежність від Lin-9 (Osterloh et al., 2006). Було встановлено, що B-Myb необхідний для видалення репресивного комплексу E2F4 у промоторі Cdc2 (Zhu et al., 2004), і, можливо, відсутність цього репресора в клітинах F9 робить цю активність зайвою. Підсумовуючи, наші результати показують, що Lin-9 необхідний для транскрипційної активації певного набору ключових генів, що беруть участь у фазовому переході G 2/M та під час мітозу.
Lin-9 асоціюється з B-Myb, але не з кишеньковими білками в клітинах F9
Попередні дослідження показали, що комплекси Lin-9 з B-Myb або кишеньковими білками p107/p130 на різних стадіях клітинного циклу (Schmit et al., 2007; Pilkinton et al., 2007a). Використовуючи імунопреципітацію та вестерн-блоттінг, було очевидно, що B-Myb осаджувався разом з Lin-9 з екстрактів клітин F9, але p107 - ні, незважаючи на його експресію в цих клітинах (рис. 3а). Подібні дослідження також проводились для p130; однак виявлено, що p130 не експресується в нормальних умовах росту в клітинах F9 (дані не наведені). Відповідно до попередніх досліджень контрольні експерименти показали, що B-Myb та p107 можуть осідати разом з Lin-9 з екстрактів клітин миші NIH3T3 (рис. 3а). Таким чином, на відміну від клітин із встановленою контрольною точкою клітинного циклу G 1/S, Lin-9 не комплексує з кишеньковими білками в недиференційованих клітинах F9, але все одно може взаємодіяти з B-Myb.
Lin-9 зв'язується з B-Myb, але не з p107 або p130 у недиференційованих клітинах F9. ( до ) Ядерні лізати клітин F9 та NIH3T3 імунопреципітували з доімунною сироваткою кроля Lin-9 (Con), антитілами B-Myb, Lin-9 та p107 та вестерн-блот для B-Myb та p107. Контроль надходження (In) містив 10% лізатів, що використовуються для імунопреципітації (ІП). ( b ) Ядерні лізати недиференційованих (F9) та диференційованих F9 (Dif. F9) клітин вестерн-блотували для маркеру диференціації Gata-4 та контролю навантаження β-актину. ( c ) Ядерні лізати диференційованих клітин F9 імунопреципітували преімунною сироваткою (Con), B-Myb, Lin-9 та p107 антитілами та вестерн-блот для B-Myb, p107 та p130. Контроль надходження (In) складав 10% лізатів, що використовувались для ІР.
Повнорозмірне зображення
Відсутність взаємодії Lin-9/p107 у клітинах F9 (рис. 3а) може бути результатом присутності конститутивно активних циклінових A/E кіназ, які інактивують функції кишенькового білка. Для перевірки цього поняття клітини F9 висівали в умовах, що індукують диференціювання ентодерми; маркер диференціації Gata-4 легко було ідентифікувати в цих клітинах, але не в необроблених клітинах F9 (Малюнок 3b). Рівні B-Myb та p107 зменшувались з диференціацією, тоді як, навпаки, активізувалася експресія p130 (рис. 3в). Важливо зазначити, що диференціювання клітин F9 викликало взаємодію між Lin-9 та p107 та p130; Виявлена залишкова взаємодія B-Myb/Lin-9 може відображати неповну диференціацію (рис. 3в). Зрозуміло, що кишенькові білки можуть комплексувати з Lin-9 лише тоді, коли клітини F9 диференціюються.
Клітини F9 містять LINC-подібний комплекс, що містить B-Myb та Lin-9
Щоб перевірити, чи потрібні інші компоненти LINC разом з Lin-9 і B-Myb для мітозу в клітинах F9, експресія Lin-54, Lin-37, Lin-52 або RbAp48 була знижена за допомогою специфічних shRNA. qPCR проводили на РНК, екстрагованій з клітин, трансфікованих shRNA, та успішне виведення Lin-54 (72%), Lin-37 (94%), Lin-52 (66%) та RbAp48 (94%) (P
Повнорозмірне зображення
Оскільки Lin-37 та Lin-52, здається, є невід'ємними компонентами комплексу B-Myb/LINC в недиференційованих клітинах F9, було зовсім несподівано, що shRNAs, націлені на ці гени, не мали очевидних наслідків для клітинного циклу (рис. 4b). Щоб переконатися, що ці білки були достатньо виснажені втручанням РНК, комплекси LINC із клітин F9, трансфіковані контрольним Lin-54, Lin-37, Lin 52 та Lin-37 shRNA, були імунопреципітовані та B-Myb за допомогою вестерн-передачі. Цей експеримент наочно продемонстрував, що споріднені shRNA виснажували Lin-54, Lin-37 та Lin-52 з комплексів з B-Myb у дуже значній мірі, тоді як комплекси з RbAp48 не виявлялись, як раніше (рис. 4е). Результати свідчать про те, що Lin-9, Lin-54 та B-Myb є критичними для мітозу, тоді як Lin-37 та Lin-52 не є важливими для цієї функції.
Lin-9 та B-Myb зв'язують та активують промотори генів G 2/M
Щоб визначити, чи Lin-9 та B-Myb функціонально взаємодіють у регуляції транскрипції конкретних генів G 2/M, ChIP оцінив зв'язування цих білків з промоторами генів Cyclin B1 та Survivin. B-Myb та Lin-9 візуалізувались у цих промоторах таким чином (рис. 5а), а qPCR виконували для кількісного визначення їх збагачення у відсотках до вхідного хроматину (рисунки 5b та 5c). Як в промоторах Cyclin B1, так і в Survivin, B-Myb та Lin-9 були значно збагачені (P
Повнорозмірне зображення
Щоб дослідити, чи Lin-9 та B-Myb спільно трансактивують промотори Cyclin B1 та Survivin, клітини F9 ко-трансфікували реципортерними плазмідами люциферази, що містять промотор Cyclin B1 або Survivin, та вектори pSuper, що кодують shRNA Lin-9 або B. Мій Б. Виснаження Lin-9 або B-Myb з клітин F9 значно знижує активність промотору Cyclin B1 порівняно з клітинами, трансфікованими контрольною shRNA (P
Повнорозмірне зображення
Щоб визначити, чи зв'язування B-Myb та/або Lin-9 з промотором Survivin було залежним від MBS, перехідні аналізи ChIP (Lavrrar and Farnham, 2004) проводили на клітинах F9, трансфікованих WT та мутованими репортерами. Для розрізнення ендогенних та репортерних промоторів, одна з кожної пари праймерів qPCR була розроблена для відпалу на основі pGL2-основного вектора або лише до ендогенного промотору Survivin. Контрольні експерименти показали, що на зв'язування B-Myb з ендогенним промотором Survivin не вплинув суттєво перехідний аналіз ChIP (додатковий малюнок S3b), хоча певний шум (∼ вдвічі) спостерігався при зв’язуванні Lin-9 набагато нижче, але ця варіація була значно нижче, ніж у трансфікованих промоторів (рис. 6г). Ефективність трансфекції була порівнянна для кожного репортера (додатковий малюнок S3c). Рівні зв'язування Lin-9 були значно знижені для кожної мутації MBS порівняно з промотором WT (P
- Продукти для активізації обміну речовин
- Ясноклітинний рак нирок Аналіз захворюваності та виживання в галузі охорони здоров'я
- Мезенхімальні стовбурові клітини в ідеях ожиріння для трансляційних застосувань - дослідження від
- Харчування для виховання своїх генів - Журнал «Жінки»
- Переривчасте голодування і сиртуїн ключі до активації омолоджуючого гена - Апперс