предметів
реферат
Нещодавно ми повідомляли, що клофазимін (МВ) має антипіроплазматичну активність, але не може повністю усунути паразитів у господаря. Наявний в даний час антипіроплазматичний препарат, диміназеноацетат (DA), іноді має токсичні побічні ефекти. У цьому дослідженні ми оцінювали комбіновану терапію CF та DA проти піроплаз in vitro та in vivo. Крім того, рівень мРНК та кількість ДНК аналізували в Babesia bovis, обробленому CF‒ та DA ', за допомогою qPCR. Комбінація CF - DA мала адитивний ефект на Babesia bovis, B. bigemina та B. caballi та синергетичний ефект на Theileria equi. Комбінована хіміотерапія CF-DA проти B. microti у мишей була ефективнішою, ніж їх монотерапія. У CF‒ та DA, оброблених B. bovis, дозозалежні від дози регульовані рівні мРНК та кількість позаядерних генів ДНК (багатих на AT), тоді як DA знижують не лише кількість позаядерних генів ДНК, а й ядерні гени. гени дещо знижувались або регулювались вгору під дією CF та DA. Нарешті, комбінація CF-DA має вищу ефективність проти піроплазм, ніж монотерапія CF або DA. CF і DA можуть мати AT-багату активність зв'язування ДНК. Усі результати свідчать про те, що комбінована хіміотерапія CF-DA буде кращим вибором для лікування піроплазмозу замість монотерапії DA.
Бабезіоз великої рогатої худоби та піроплазмоз коней спричиняють величезні економічні втрати у всьому світі, особливо в тропічних та субтропічних районах 1, 2. На сьогодні доступні антипіроплазматичні препарати, диміназеноацетат (DA) та імідокарб дипропіонат іноді мають токсичні побічні ефекти 3. Крім того, повідомлялося про стійку до DA Babesia gibsoni та розвиток стійкого до імідокарбу дипропіонату Theileria equi 4, 5. Тому терміново потрібні менш токсичні, недорогі та ефективні антипіроплазмові хіміотерапії.
Нещодавно ми повідомляли, що клофазимін (CF) має сильний інгібуючий ефект на ріст піроплазій, але CF не може повністю усунути B. microt у мишей 6. CF - це антибіотик, який застосовується в комбінованій хіміотерапії проти прокази 7. Повідомлялося, що МВ навряд чи призводить до розвитку резистентності 8, але Zhang et al. 9 нещодавно повідомили, що кілька мутацій в генах пов'язані із стійкістю до CF у бактерій.
У цьому дослідженні ми досліджували вплив комбінації CF-DA на in vitro ріст B. bovis, B. bigemina, B. caballi та T. equi та його хіміотерапевтичну активність проти B. microti у мишей. На додаток до аналізів інгібування росту вивчали активність зв'язування ДНК, багату на AT, для визначення способу дії CF та DA у B. bovis за допомогою кількісного аналізу ПЛР (qPCR).
Результати і обговорення
Стіл в натуральну величину
Стіл в натуральну величину
Стіл в натуральну величину
Стіл в натуральну величину
Відповідно до попереднього дослідження 6, ефект 20 мг/кг МВ був порівнянним, а іноді і вищим, ніж ефект 25 мг/кг DA. Тому 25 мг/кг, що є найвищою дозою, вважалося вихідним для вибору дози в комбінованій терапії в експерименті на мишах. Крім того, неоднакові співвідношення доз у комбінаціях в аналізі інгібування in vivo подібні до таких у аналізі інгібування in vitro. Ріст B. microti суттєво пригнічувався у всіх групах лікування (II-25 мг/кг DA, III-20 мг/кг CF, IV-15 мг/кг CF та 10 мг/кг DA та V-10 мг/кг) . кг CF та 15 мг/кг DA) порівняно з необробленою групою (I-0,2 мл кунжутного масла та фізіологічного розчину) (рис. 1). Статистично значуща нижча різниця (P 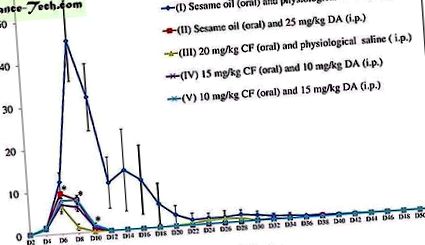
Зростання B. microti у необроблених (I), 25 мг/кг DA (II) -, 20 мг/кг CF (III) -, 15 мг/кг CF та 10 мг/кг DA комбінації (IV) - та 10 мишей з дозою мг/кг МВ та 15 мг/кг комбінації DA (V) протягом 52 днів. Стрілка вказує 5 днів поспіль лікування. Зірочки вказують на статистично значущі (P
Значення гематокриту у нелікованих, 25 мг/кг DA -, 20 мг/кг CF -, 15 мг/кг CF і 10 мг/кг DA комбінацій - і 10 мг/кг CF та 15 мг/кг DA комбінацій оброблених мишей . Стрілка вказує 5 днів поспіль лікування. Зірочки вказують на статистично значущі (P
ПЛР-виявлення B. microti від мишей, оброблених CF‒ або DA ', на 52 день після зараження. a ) у зразках ДНК крові: G1, необроблений; G2, 25 мг/кг DA; G3, 20 мг/кг МВ; Поєднання G4, 15 мг/кг CF та 10 мг/кг DA; Поєднання G5, 10 мг/кг CF та 15 мг/кг DA. ( b - f ) у зразках ДНК тканини: M, розмір маркера 100 bp; ПК, позитивний контроль; Br. Sp., Селезінка; Лі., Печінка; Кі., Нирки; Він, серце, NC, негативний контроль. Подвійні смуги, що спостерігаються у деяких позитивних контролях, представляють амплікони першої та другої ПЛР. Для зменшення концентрації матричної ДНК спостерігали лише одну смужку (дані не наведені). ( g ) Інфекційність B. microti у мишей, перелитих еритроцитами. Паразитемію розраховували шляхом підрахунку заражених еритроцитів серед 500 еритроцитів.
Повнорозмірне зображення
Комбіновані хіміотерапії CF-DA, як правило, ефективніші, ніж їх монотерапії, незважаючи на різні схеми дозування, що застосовуються як в аналізах інгібування in vitro, так і in vivo, тому комбінована хіміотерапія, ймовірно, зменшує токсичні побічні ефекти на господаря. Однак для підтвердження нашої гіпотези слід провести подальші дослідження для виявлення можливих токсичних побічних ефектів, пов’язаних із комбінованою терапією CF-DA.
Рівні мРНК у B. bovis, оброблених CF або DA. ( a ) 4 мкМ паразитів, оброблених CF та DMSO. ( b ) паразити, оброблені 15 мкМ CF і оброблені DMSO. ( c ) Паразити, оброблені 6,5 мкМ DA та водою Milli-Q (M-QW). ( d ) паразити, оброблені 19,5 мкМ DA та M-QW. Зірочки вказують на статистично значущі (* P 14, 15) Ми висунули гіпотезу, що порівняння відмінностей кратних змін рівнів мРНК ядерних, мітохондріальних та апіколастних генів між обробленими CF та DA паразитами, що не отримували лікування, виявило зв'язок з ДНК- зв'язуюча активність цих препаратів. CF не інгібує РНК-полімеразу 8, а активність зв'язування РНК CF і DA незрозуміла, тому ми дослідили кількість ДНК-ядерних, мітохондріальних та апікопластичних генів між CF- або DA та необробленими паразитами за допомогою аналізу qPCR .
Для аналізу кількісної оцінки ДНК зміни кількості екстрануклеарних генів ДНК у паразитів, оброблених 4 та 15 мкМ CF, залежали від дози порівняно з паразитами, обробленими ДМСО. гени для котів не були і дещо регульовані (рис. 5а та б). Крім того, кількість ДНК ядерних генів не регулювалася, тоді як кількість екстрануклеарних генів було зменшено у 6,5 мкМ паразитів, оброблених DA, порівняно з паразитами, обробленими M-QW (рис. 5c). У випадку 19,5 мкМ паразитів, оброблених DA, спостерігалася регуляція збільшення кількості ДНК ядерних генів, тоді як регуляція зниження спостерігалася на генах мітохондрій та апікопластів порівняно з контролем (рис. 5г).
Кількість ДНК у B. bovis, обробленої CF або DA. ( a ) 4 мкМ паразитів, оброблених CF та DMSO. ( b ) паразити, оброблені 15 мкМ CF і оброблені DMSO. ( c ) Паразити, оброблені 6,5 мкМ DA та водою Milli-Q (M-QW). ( d ) паразити, оброблені 19,5 мкМ DA та M-QW.
Повнорозмірне зображення
Результати qPCR дозволяють припустити, що CF та DA пов'язують багаті на AT мітохондрії та апіколасти для інгібування біосинтезу мРНК та ДНК екстрануклеарних генів у B. bovis. Навпаки, DA не може пригнічувати біосинтез мРНК всіх генів, а також CF і DA можуть не бути токсичними для біосинтезу мРНК та ДНК ядерних генів.
Нарешті, комбінація CF-DA продемонструвала адитивний ефект на ріст B. bovis, B. bigemina та B. caballi in vitro та синергетичний ефект на ефекти T. equi та комбіновану хіміотерапію із низькими дозами схем CF та DA мають сильніший інгібуючий ефект на мікроти B у мишей, як їх монохіміотерапія. Подібний спосіб дії CF і DA, який пов'язаний з активністю, багатою на AT, свідчить про те, що ці препарати в поєднанні можуть сприяти співпраці проти паразитів Babesia. Усі ці результати свідчать про те, що комбінована хіміотерапія CF-DA є кращим вибором для лікування піроплазмозу тварин порівняно з монохіміотерапією CF та DA. Подальша оцінка ефективності комбінованої терапії B. bovis та B. bigemina у великої рогатої худоби та B. caballi та T. equi у коней буде необхідною для подальшого використання цієї терапії проти піроплазмозу у тварин. Крім того, у наступних дослідженнях слід віддати перевагу вивченню комбінованої терапії з МВ та атоваквоном, азитроміцином або кліндаміцином, які зараз є доступними препаратами від бабезіозу людини.
Матеріали і методи
Заява з етики
Всі експерименти на тваринах проводились відповідно до норм щодо управління та експлуатації експериментів на тваринах, а також усіх експериментів на тваринах та ДНК, затверджених Комітетом з догляду та використання тварин та Комітетом з біобезпеки для патогенів та Університетом сільського господарства та ветеринарної медицини Обіхіро, Хоккайдо, Японія (номер приєднання експерименту на тваринах: 28–110/28–111; експеримент з ДНК: 201325-4/201321-4). Всі експерименти в цьому дослідженні проводились відповідно до Основних вказівок щодо поведінки тварин та супутніх видів діяльності в академічних науково-дослідних установах під юрисдикцією Міністерства освіти, культури, спорту, науки та технологій, Японія.
Паразити та тварини
Культури штату Техас in vitro штаму B. bovis, штаму Аргентини B. bigemina та штамів USDA B. caballi та T. equi підтримували, як описано вище 25, 26, 27 .
Для експериментальної моделі на тваринах був використаний мюнхенський штам B. microti та самки мишей BALB/c віком 8 тижнів (придбані у CLEA Japan, Inc., Токіо, Японія).
Хімічні речовини та реактиви
Всі хімічні речовини та реактиви були придбані у Sigma-Aldrich (Токіо, Японія), крім DA (Novartis Animal Health). CF і DA розчиняли при 10 мМ в DMSO та M-QW як вихідні розчини для аналізу інгібування in vitro. Розчинники CF та DA (DMSO та M-QW) використовували в контрольних культурах у тих же концентраціях, що і для приготування найвищої концентрації цих препаратів у кожному аналізі інгібування in vitro. Для аналізу in vivo інгібування 10, 15 і 20 мг/кг CF та 10, 15 і 25 мг/кг DA розчиняли в кунжутній олії та фізіологічному розчині в автоклаві (0,9% NaCl w/v, pH 7,2). безпосередньо перед лікуванням.
Аналіз комбінованого інгібування CF-DA in vitro
Оцінка in vivo хіміотерапевтичної активності комбінацій CF - DA
Аналіз інгібування in vivo проводили, як описано вище. Коротко кажучи, мишам (5/група) вводили внутрішньочеревно 1 x 10 7 B-мікроінфікованих еритроцитів. Паразитемія та гематокрит контролювали кожні 2 та 4 дні за допомогою мікроскопії та автоматичного гематологічного аналізатора Celltac та MEK-6450 (Nihon Kohden Corporation, Токіо, Японія). Коли паразитемія вище 1% спостерігалася у всіх мишей, групи I, II, III, IV та V обробляли 0,2 мл кунжутного масла та фізіологічного розчину як необроблений контроль, 0,2 мл кунжутного масла та 25 м/кг DA, 20 мг ./кг МВ та 0,2 мл фізіологічного розчину, 15 мг/кг CF та 10 мг/кг DA та 10 мг/кг CF та 15 мг/кг DA. CF та кунжутне масло та DA та фізіологічний розчин вводили перорально та внутрішньочеревно, відповідно, протягом п’яти днів поспіль. Паразитемію розраховували шляхом підрахунку заражених еритроцитів серед 2000 еритроцитів за допомогою пофарбованих за Гімзою тонких мазків крові, що готувались кожні два дні, поки жодної миші не виявили паразита. Експеримент повторили тричі.
Виявлення ПЛР та інфекційність обробленого B. microti
Після аналізу інгібування in vivo всім мишам знеболювали, а потім збирали кров (збирали серцевою пункцією), мозок, серце, селезінку, нирки та печінку та використовували для екстракції ДНК. Аналіз ПЛР проводили, використовуючи процедуру 6, описану вище .
1 × 10 8 еритроцитів з I - V груп трансфікували в 5 нових груп мишей (3/група) шляхом інтраперитонеального введення. Паразитемію контролювали за допомогою забарвлених за Гімзою тонких мазків крові, що готувались кожні три дні протягом 36 днів.
Дводенний тест на інгібування та ранні морфологічні зміни та розвиток B. bovis, оброблених CF або DA
Дев'яносто мікролітрів культурального середовища GIT, що містить CF при 0, 1, 0, 5, 1, 1, 5, 2, 2, 5, 3 і 4 мкМ або DA при 0, 01, 0, 05, 0, 1, 0, 25, 5, 1 та 2 мкМ, 0,04% ДМСО або 0,08% M-QW додавали в 96-лункову культуральну пластинку у трьох примірниках. 10 мікролітрів 1% паразитованих еритроцитів (10% гематокриту) додавали в кожну лунку 27,29. Культури інкубували протягом 2 днів, а середовище з лікарськими засобами та контролем змінювали на 0 та 1 день культур. Значення IC25, IC50 та IC75 визначали на 2-й день мікроскопічного дослідження та аналізу на основі флуоресценції окремо, як описано вище, з невеликими змінами 27,29. Експеримент повторили тричі.
Морфологічні зміни паразитів B. bovis, оброблених CF або DA, спостерігались через 0, 5, 1, 2, 4, 6, 8, 12, 24, 36 та 48 годин у стінках еритроцитів за допомогою мікроскопії. Парні та одноклітинні стадії внутрішньоеритроцитарного паразита контролювали у 400 iRBC у фарбуванні Гімзи. Культури проводили за попереднім методом із незначними модифікаціями: 900 мкл культурального середовища GIT, що містить CF або DA у кінцевих концентраціях IC25, IC50 та IC75, 0,02% DMSO або 0,03% M-QW додавали до 24-лункової культуральної пластини в тричі. У кожну лунку додавали 100 мкл 1% паразитованих еритроцитів (10% гематокриту). Поживні середовища з лікарськими препаратами та контролем були змінені через 0 та 24 години культури.
Одноденний аналіз інгібування та кількісне визначення мРНК та ДНК у B. bovis, оброблених CF або DA
IC 50 та IC 75 CF та DA щодо B. bovis визначали з використанням 8 різних концентрацій кожного препарату та контролю (0,4% DMSO або 0,2% M-QW) у трьох примірниках. Дев'яносто мікролітрів живильного середовища GIT (без сироватки) без лікарських засобів та контролів та 10 мкл 1% паразитованих еритроцитів (10% гематокриту) додавали в 96-лункову культуральну пластинку на 0-й день культур, як описано вище, з невеликою модифікацією 27 . На 1 день 90 мкл культурального середовища GIT замінювали на культуральне середовище GIT з CF (у кінцевих концентраціях: 0, 5, 1, 2, 3, 4, 10, 20 та 40 мкМ), DA (у кінцевих концентраціях: 0, 1, 1, 2, 4, 6, 8, 10 і 20 мкМ) або контролі. Значення IC50 та IC75 визначали на 2 день культури шляхом мікроскопії з використанням забарвленого за Гімзою барвника RBC. Експеримент повторили тричі.
Для отримання РНК та ДНК культивування проводили згідно з 1-денним аналізом інгібування з 2000 мкл культур у 12-лунковій платівці з культурами, що містить 1800 мкл культурального середовища GIT та 200 мкл iRBC. Тисяча вісімсот мікролітрів культурального середовища GIT замінено рівним об’ємом культурального середовища GIT, що містить CF або DA при IC50 та IC75 або контролях (у кінцевих концентраціях: 0,15% DMSO та 0,195% M-QW) на 1 день культур. Заражені еритроцити збирали на 2 день культур.
РНК і ДНК витягували з 200 мкл iRBC реагентом TRIzol (Invitrogen, Каліфорнія, США) або набором QIAamp DNA Blood Mini (QIAGEN, Токіо, Японія) з розщепленням РНКази А (Takara Bio Inc., Otsu, Японія). відповідно до інструкцій виробника. РНК очищали за допомогою міні-набору QIAamp RNA Isolation Blood Mini (QIAGEN, Токіо, Японія) з перетравленням рекомбінантної ДНКази I (Takara Bio Inc., Otsu, Японія), а потім піддавали синтезу кДНК із використанням праймера Hendamers Random (Takara Bio Inc., Оцу, Японія). Конкретні праймери (таблиця S2) були розроблені з використанням ядер (18S рРНК, бета-ланцюга тубуліну та Arm/cat; номери приєднання GenBank: L19077, XM_001611566 та XM_001612062, відповідно), мітохондрії (cob та cox3; номер приєднання GenBank: AB499088) та послідовності апікопласти (tufA та clpC; GenBank: NC_011395) з використанням програмного забезпечення Primer Express® (Life Technologies, Thermo Fisher Scientific). Аналіз qPCR проводили з використанням Master SYBR® Green PCR Master Mix (Applied Biosystems, Warrington, UK). Повторні зміни генів-мішеней у порівнянні з 18S рРНК визначали у оброблених CF або DA та DMSO або M-QW B. bovis, як описано вище. .
Статистичний аналіз та формула ICFIC
Стандартне відхилення було розраховано в 3 окремих експериментах і статистично значуща різниця (Р 1 і 2 і 4 вказує на значний антагонізм, як описано вище 18 .
Оцінка індексу FIC базується на наступній формулі:
У qPCR стандартні відхилення розраховували в межах 3 незалежно культивованих культур необроблених або оброблених груп, і кожен цикл дублювали згідно з раніше описаним методом та принципом статистичного аналізу 30, 31 .
Дякую
Ця робота була фінансово підтримана грантом спільних досліджень від Національного дослідницького центру найпростіших хвороб Університету сільського господарства та ветеринарної медицини Обіхіро (28-спільний-4).
Електронний додатковий матеріал
Додаткова інформація
Коментарі
Надсилаючи коментар, ви погоджуєтесь дотримуватися наших Загальних положень та умов та Правил спільноти. Якщо ви вважаєте, що це образливий вчинок, який не відповідає нашим умовам чи інструкціям, повідомте про це як про недоречний.
- Bhringaraja Natural Aurrowda Hair Airveda Anti Hair Hair Hair Medic
- Pronamel Whitening відбілююча зубна паста 75 мл - природний шлях до здоров’я
- Деннік N бореться з підманами Ми вже летіли в редакцію, каже редактор - Іноді Нечас
- Антицелюлітні вправи
- Біофриз при болях у м’язах, суглобах та спині - АПТЕКА ЛІКАР
