предметів
реферат
Ожиріння є глобальною проблемою охорони здоров'я як у розвинених країнах, так і в країнах, що розвиваються, що не є ефективною стратегією запобігання його поширеності. За даними Всесвітньої організації охорони здоров’я (ВООЗ), якщо індекс маси тіла (ІМТ) дорівнює або перевищує 25 кг/м 2, він вважається надмірною вагою, тоді як якщо він дорівнює або перевищує 30 кг/м 2, вважається ожирінням 1. За останні десять років тенденції до популяції демонструють 40% збільшення надмірної ваги або ожиріння до вагітності та двократне збільшення захворюваності на ожиріння до вагітності 2. Для репродуктивної системи людини високий ІМТ негативно впливає на фертильність від ендокринних розладів 3, ановуляції 4 та зниження якості ооцитів 5 до сприйнятливості ендометрія, що може спричинити рівень спонтанного аборту 6. Тому все більше жінок з ІМТ репродуктивного віку повинні повернутися до допоміжних репродуктивних технологій (АРТ) для вирішення свого безпліддя.
Однак використання свіжого перенесення ембріонів (ET) може дозволити розладам ендометрія, спричиненим стимуляцією яєчників, зберігатись і впливати на наступні вагітності та акушерські результати у жінок з АРТ. І спостережні дослідження показали, що група FET мала значно більший показник клінічної вагітності за кожну передачу, ніж група ET 11. Техніка заморожування з'явилася в 1996 р. 12, потім перші пологи з використанням вітрифікації ооцитів були зафіксовані в 1999 р. 13, приблизно через 10 років з'явилася перша вагітність внаслідок вітрифікації ембріонів 14. Технологія заморожування, яка широко використовується у всьому світі, використовується як важливий прорив у репродуктивній біології з 2004 року. Кріоконсервація ооцитів та ембріонів може досягти понад 90% виживання при чудовому рівні виживання, і шанси на вагітність рівноцінні. ті, хто має нові трансфери 15, а іноді навіть краще 16. Перенесення заморожених ембріонів не тільки дозволяє яєчнику та відкритому ендометрію відновитись після стимуляції яєчників, але також дозволяє уникнути небажаного впливу високих рівнів естрадіолу на імплантацію. Тому технологія FET може підвищити ефективність АРТ у жінок із ожирінням і стати першим вибором.
Жінки з високим ІМТ мають подібні риси, як жінки з СПКЯ, такі як нижчий рівень прогестерону. Чи може протокол PPOS у поєднанні з FET стати адаптивною терапією для жінок з високим ІМТ, що здається дуже перспективним та значущим. Зокрема, ми розглянемо сучасні методи лікування жінок з високим ІМТ, переважно стандартні протоколи довгих агоністів GnRH, протокол спалаху мікродози GnRH, протокол антагоністів GnRH, протокол надмірної довжини або протокол збільшеної довжини 26, 27, 28, 29 у поєднанні з ЕТ, які завжди зменшують результати вагітності та живонародження. Тому ми проводимо цей ретроспективний аналіз для дослідження результатів вагітності ооцитів та PPOS у поєднанні зі стратегією лікування FET у жінок з високим ІМТ.
результат
Клінічні характеристики та результати ЕКО дають дві групи ІМТ за технологією FET
У таблиці 1 представлені основні характеристики та результати ЕКО за допомогою технології FET у пацієнтів двох груп ІМТ. Було 2212 жінок із нормальним ІМТ та 320 жінок із високим ІМТ (21, 28 проти 27, 13; с 26, 27, 28, 29, базальний ФСГ (5, 00 проти 5, 66, с 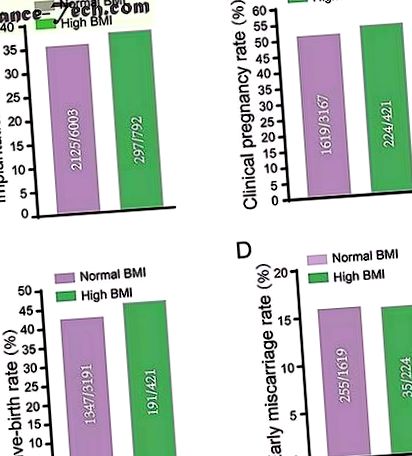
Нормальний ІМТ та групи з високим ІМТ не мали різниці у швидкості імплантації ( A ), клінічна вагітність B ), народжуваність ( C. ) і швидкість абортів на ранніх термінах ( D ) після FET. Вихідні дані були показані на малюнках та проаналізовані за допомогою тесту Хі-квадрат. Різниці вважали статистично значущими, коли значення р було менше 0,05.
Повнорозмірне зображення
Характеристика циклу та ооцитів призводять до трьох груп стимуляції яєчників відповідно до ІМТ у жінок
Потім у поєднанні з технологією FET ми проаналізували результати ЕКО наших трьох різних груп стимуляції яєчників: звичайні короткі, hMG + MPA (4 мг/добу) та hMG + MPA (10 мг/добу) окремо при нормальному ІМТ (18, 5 -24, 9 кг/м2) та групи з високим ІМТ (≥25 кг/м2) у жінок. Базові характеристики, гормональні профілі та характеристики циклу пацієнта показані в таблиці 2. Спочатку ми проаналізували результати ЕКО у тих самих жінок з ІМТ, використовуючи три різні групи стимуляції яєчників, у таблиці 2. Для нормальної групи жінок ІМТ був тривалістю hMG. значно довший у групі з hMG + MPA (10 мг/добу), ніж у звичайній групі з короткою концентрацією та hMG + MPA (4 mg/d) (8, 94 проти 8, 14 проти 6, 87, с
Порівняння показників імплантації ( A ), клінічні показники вагітності B ), народжуваність C. ) і швидкість абортів на ранніх термінах ( D ) у трьох групах стимуляції яєчників відповідно до ІМТ жінки за FET. Вихідні дані були показані на малюнках та проаналізовані за допомогою тесту Хі-квадрат. * стор. 26, 27, 30. Тому дискусія між якістю ооцитів та сприйнятливістю ендометрія є основною причиною того, чому він залишається високим ІМТ жінки, як і раніше. Однак високий ІМТ не впливає на результати ЕКО у жінок із ожирінням, які використовують донорські ооцити, що припускає, що у жінок із ожирінням якість ооцитів може бути найважливішим фактором, а не сприйнятливістю ендометрія 10. Наші результати показали, що під час трьох процедур стимуляції яєчників група ІМТ з високим ІМТ (ІМТ ≥ 25) спочатку зменшила придбані ооцити, ооцити МІІ, запліднені ооцити, ембріони найвищої якості та життєздатні ембріони, як нормальна група ІМТ, але після Польовий транскрипційний ефект цього побічного ефекту: ефективність ооцитів у жінок з високим ІМТ була змінена і досягла подібних результатів вагітності, як нормальний ІМТ жінок. Застосування FET може зменшити відмову ендометрія, спричинену імітацією яєчників.
Наші дослідження також мають обмеження. По-перше, це проект ретроспективного дослідження, який у майбутньому повинен бути підтверджений рандомізованим контрольованим випробуванням. По-друге, у групі з високим ІМТ у нашому дослідженні була лише одна група (ІМТ ≥ 25), що краще, якщо ділити їх точніше, якщо вона має достатню кількість циклів, таких як надмірна вага (ІМТ 25, 0-29, 0), ожиріння (ІМТ 30, 0–49, 9) та суперобеза (ІМТ> 50). Хоча обидві групи hMG + MPA покращили клінічні результати в цій групі з високим ІМТ, і чим більше використовується MPA, тим кращі результати ЕКО. Ці дві групи hMG + MPA (4 або 10 мг/добу) мають послідовний та дозозалежний терапевтичний ефект у групі з високим ІМТ, що допомагає підтвердити дію MPA у жінок з високим ІМТ. По-третє, у групі з високим ІМТ у нас не було контролю ЕТ, що допомогло б нам знати про покращення результатів вагітності у жінок з високим ІМТ, які спочатку мали низькі показники ооцитів, ніж нормальний ІМТ жінок, безпосередньо викликаний транзитним транзистором або іншими факторами. так багато попередніх досліджень показують, що при застосуванні ЕТ жінки з високим ІМТ спостерігали б такі несприятливі показники під час вагітності, як у яйцеклітини.
На закінчення можна висловити гіпотезу, що протокол стимуляції яєчників hMG + MPA (4 або 10 мг/добу) у поєднанні з технологією FET може бути ефективним та прийнятним методом лікування для жінок з високим ІМТ (≥25) порівняно із звичайним коротким протоколу та для жінок з високим ІМТ hMG + МФК (10 мг/добу) є найбільш ефективною стратегією лікування у трьох з них. Результати свідчать про те, що протокол hMG + MPA (4 або 10 мг/добу) може бути більш ефективним із багатьма теоретичними перевагами, такими як FET, який дозволить краще оцінити яєчники та оголений ендометрій від стимуляції яєчників, таким чином уникаючи небажаних високих рівні естрадіолу при імплантації та МФК можуть частково покращити розвиток ооцитів, крім того, МФК (10 мг) суттєво доповнює дефіцит прогестерону у жінок з високим ІМТ і, швидше за все, досягне успіху ЕКО.
методи
Оцінка індексу маси тіла
Вага та зріст використовувались для обчислення ІМТ за стандартною формулою: ІМТ = вага/зріст 2 (кг/м2). Суб'єкти, які відповідали вимогам, були розділені на дві групи залежно від ІМТ пацієнтів та на основі стандартів Всесвітньої організації охорони здоров'я: нормальна група ІМТ (18,5 кг/м2 ≤ ІМТ 2) 1. А дані ІМТ базувались на виміряних висотах і вагах в медичній картці кожного пацієнта.
Протоколи стимуляції яєчників
Звичайний протокол короткої стимуляції яєчників
Як контрольна група використовувався стандартний короткостроковий протокол. Пацієнти отримували 0,1 мг триптореліну щодня від менструального циклу 2 (MC2) до часу введення хоріогонадотропіну (HCG) людини та екзогенного hMG (150-225 IU) на MC3 щодня. Через 4-5 днів введення hMG проводили ультразвукове трансвагінальне дослідження та тести на рівень гормонів у сироватці крові, і дозу hMG оптимально коригували залежно від кількості та розміру фолікулів, що розвиваються. Кінцева стадія дозрівання ооцитів була індукована внутрішньом’язовим введенням hCG (Lizhu Pharmaceutical Trading Co., Чжухай, Китай) після того, як домінантні фолікули досягли діаметра 18 мм. Якщо у пацієнта було більше трьох домінантних фолікулів, вводили 2000 МО hCG, тоді як у пацієнтів з до трьох домінантних фолікулів для запуску використовували 5000 IU hCG. Через 34 - 36 годин пізніше проводили трансвагінальний збір ооцитів під контролем ультразвуку.
Протокол PPOS
Детальний опис процедури hMG + MPA наведено в нашій попередній публікації 17. Коротко кажучи, стимуляцію яєчників розпочали у пацієнтів починаючи з MC3, ін'єкцією 150-225 МО hMG (Anhui Fengyuan Pharmaceutical Co. Ltd, Хефей, Китай) та MPA (4 мг/добу або 10 мг/добу) 17. Початкову дозу 150 МО/добу застосовували у пацієнтів з високим числом АФК понад 20 або злегка підвищеним базальним ФСГ (7-10 МО/л), тоді як у всіх інших пацієнтів застосовували 225 МО/добу. Попередні дослідження контрацепції показали, що 10 мг МФА можна використовувати для інгібування овуляції, тоді як 5 мг МФА не змогли пригнічити овуляцію 54, ймовірно, 10 мг МФА може бути кращим для запобігання передчасному підвищенню рівня ЛГ в контрольованому середовищі стимуляції яєчників. У цьому дослідженні ми обрали 4 мг та 10 мг МФК, щоб дослідити оптимальну дозу МФК для подальшого вивчення ефективності дози. Коли три домінантні фолікули досягли діаметру 18 мм, на заключній стадії дозрівання ооцитів співпрацювали з ін’єкціями триптореліну (0,1 мг, декапептил, Феррінг Фармасьютікс) та hCG (1000 МО; Lizhu Pharmaceutical Trading Co.). Ооцити отримували трансвагінальною аспірацією через 34-36 год після овуляції.
Оцінка результатів ЕКО
Пацієнти проходили лікування ЕКЗ, яке проводилося згідно з рутинними лабораторними процедурами в день вилучення ооцитів, як описано вище 55, 56. Коротко, для промивання ооцитів використовували середовище для промивання (Origio Medical Company, Данія), а також використовували людську трубну рідину (HTF; Irvine Scientific, Каліфорнія, США) з 10% добавками, що замінюють сироватку (SSS; Irvine Scientific, CA, USA). як середовище для збору та осіменіння ооцитів. Ембріони культивували в 10% -SSS з доповненням до середовища безперервної одноразової культури (CSC; Irvine Scientific, Каліфорнія, США).
Ембріони 3-го дня з кожного циклу лікування ЕКО тестували на кількість та регулярність бластомерів та ступінь фрагментації ембріона згідно з критеріями Каммінса 57. Ембріони І та ІІ ступенів, які вважалися вищою якістю, були збережені заморожуванням; Ембріони ІІІ та IV ступенів поміщали у витягнуту культуру до досягнення стадії бластоцисти, і лише морфологічно добрі бластоцисти заморожували на 5-й день або 6-й день. Процедуру вітрифікації ембріонів та бластоцист на замороженій стадії травлення проводили за допомогою системи Cryotopcarrier Кітазато). Biopharma Co.), як згадано вище 58. Для склування використовували систему кріотопних носіїв із сумішшю 15% (об./Об.) Етиленгліколю (ЕГ), 15% (об./Об.) Диметилсульфоксиду (ДМСО) та 0,5 М сахарози як розчину кріопротектора. Розчини 1, 0, 5 та 0 М сахарози використовували для розморожування для поступового розведення кріопротектора.
Підготовка ендометрію та перенесення замороженого ембріона
Підготовка ендометрію до кожного циклу передачі проводилась у природний цикл, м’який цикл стимуляції або замісна гормональна терапія, як описано в попередніх статтях 19, 21. Наш метод ембріональної та ендометріальної синхронізації FET був таким: для природних циклів FET ріст фолікулів контролювали за допомогою сироваткових гормонів та ультразвуку з дня 10. > 150 пг/мл та Р 8 мм, Femoston (Solvay Pharmaceuticals BV) розпочато з 8 мг/добу. Перенесення ембріонів визначали на третій день після введення Фемостону.
У всіх циклах FET один або два розморожені ембріони передавались відповідно до наміру пацієнта. Після досягнення вагітності екзогенні добавки естрогену та прогестерону тривали до 8-10 тижнів вагітності.
Статистичний аналіз
Дякую
Автори дякують безплідним жінкам-учасницям, а також усім лікарям, медсестрам та персоналу лабораторій, зайнятих у відділі допоміжної репродукції Дев'ятої народної лікарні Шанхайської школи університету Цзяотун. Дякуємо, що РГ допомагає переглянути англомовні орфографічні та граматичні помилки в рукописі. Ця робота була підтримана грантами Фонду природничих наук Китаю (номер гранту: 31400970 LW, 15411953000, 81571397до YK) та Фонду природничих наук Шанхаю (номер гранту: 15ZR1424900 QL).
Коментарі
Надсилаючи коментар, ви погоджуєтесь дотримуватися наших Загальних положень та умов та Правил спільноти. Якщо ви вважаєте, що це образливий вчинок, який не відповідає нашим умовам чи інструкціям, повідомте про це як про недоречний.
- Насіння льону Інок проти раку!
- Будуть інші вправи при остеохондрозі грудної клітки! Комплекси вправ при остеохондрозі грудного відділу хребта
- Інші нормальні жири, середні чи з високим вмістом білка, на масу тіла у пацієнтів із
- Фотографії - втрата ваги та результати - с
- Фотографії - втрата ваги та результати - с
