Мікробіологічні умови вирощування хелікобактер пілорі
Мартін Алонсо Байона Рохас, бакт., Особливо, магістр. (1)
(1) Професор Медичного факультету Групи біомедичних досліджень та прикладної генетики (GIBGA). Університет прикладних та екологічних наук U.D.C.A. Богота, Колумбія. електронна адреса: [email protected]
Дата отримання: 09-17-12 Дата прийняття: 16-16-13
Своєчасна діагностика та культура хелікобактер пілорі Велике значення має вивчення особливостей його росту, а також внесок у пізнання класичної та молекулярної епідеміології, генетичного різноманіття та сприйнятливості до антибіотиків. Повсюдність і важливість цього мікроорганізму як збудника у всьому світі змушує нас розглядати та пропонувати ефективні альтернативи для виділення та рутинної ідентифікації його в мікробіологічних лабораторіях. Цей огляд був спрямований на опис літератури щодо умов, необхідних для вирощування цього мікроорганізму в лабораторії.
Ключові слова
хелікобактер пілорі, мікробіологія, ізоляція, мікробна культура.
ПІДСУМОК
Розраховано, що H. pylori заражає від 50 до 75% населення світу. З кожних 10 людей, заражених цим мікроорганізмом, лише один страждає хворобою, а дев’ять ніколи не розвиваються. Інфекція етіологічно пов’язана з наявністю пептичної виразки шлунка або дванадцятипалої кишки, а також з розвитком особливого типу лімфоми шлунка, яка називається мальтомою; так само він бере участь у етіологічному багатокаузальному ланцюгу розвитку раку шлунка (1). Насправді, Всесвітня організація охорони здоров’я класифікувала цей збудник як біологічний канцероген для людини (категорія 1), де найбільша частота зараження спостерігається в дитинстві в країнах, що розвиваються, і, схоже, пов’язана з економічними умовами. Та несприятливими гігієнічно-санітарними (2, 3). Здається, різні штами пов’язані з різноманітністю вірулентності та взаємодією факторів, включаючи етнічне походження, погане харчування, перенаселеність, географію та вік (4).
У цій статті представлений огляд мікробіологічних аспектів, орієнтованих на врожаї, та факторів, що в них позначаються. Для бібліографічного пошуку були досліджені такі бази даних: Medline, Proquest, Embase, Jstore, Pubmed, Hinary, Springer, Nature, Science онлайн та Oxford Journal, а також у приватних журналах, таких як Plos, Nas та Imbiomed. Терміни були об’єднані: Хелікобактер та обслуговування, Додатки для Хелікобактер, Технічне обслуговування лабораторії, посів на твердому середовищі, сприйнятливість до антибіотиків.
У Колумбії у дослідженні, проведеному Університетом дель Валле за фінансування Колумбійського інституту розвитку науки і техніки, вони повідомили про поширеність 69,1% інфекції H. pylori в регіональних лікарнях 16 департаментів Колумбії на зразках біопсії, взятих з ендоскопії верхніх відділів травного тракту. У попередні десятиліття дослідження причин кислото-пептичної хвороби та аденокарциноми шлунка зосереджувались насамперед на дієтичних факторах, але відкриття H. pylori як частий шлунковий збудник він змінив етіологічні уявлення про ці та інші гастродуоденальні захворювання (5).
Вивчення H. pylori У нашій країні це почалося наприкінці попереднього десятиліття, і є небагато звітів лабораторій, що мають досвід мікробіологічних навичок, необхідних для його ізоляції та вирощування (6).
МІКРОБІОЛОГІЧНІ ХАРАКТЕРИСТИКИ
Члени роду Хелікобактер були описані в 1989 р., вони колонізують шлунок і кишечник людини та деяких видів тварин, це вигнута мікроаерофільна грамнегативна паличка, вона має зовнішню мембрану та 4 - 8 полярних джгутиків, захищених оболонкою ліпідної структури. Серед ферментів, які він виробляє, є: уреаза, каталаза та цитохромоксидаза. Уреаза є одним з факторів бактеріальної вірулентності H. pylori який перетворює сечовину в NH3 та воду, підщелачуючи тим самим навколишнє кисле середовище; інші фактори представлені в ліпазі, адгезинах, каталазі, факторі активації тромбоцитів, білку гена, асоційованого з цитотоксином, Cag A, pic B (який індукує цитокіни) та вакуолізуючому цитозині Vac A (3, 7).
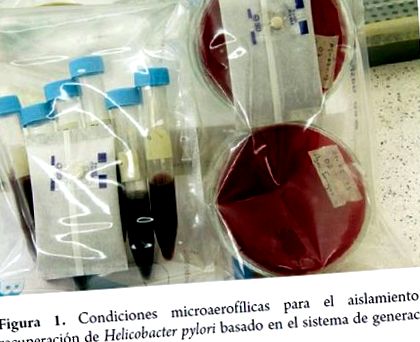
Для культури беруть зразки зі слизової шлунка та позашлункові зразки, відібрані із зубних відкладень, прямої кишки, сечового міхура та стравоходу; час, необхідний для формування колоній, досягається від 4 до 7 днів за умов: 5-10% 02; 5-10% С02; 80-90% N2, 95% вологості та температури 35-37 ° C. Зазвичай його вирощують у складних середовищах з кров’ю, сироваткою та антибіотиками (7).
УМОВИ ВІДБОРУ ПРОБ
Рекомендований протокол для проведення біоптатів у хворих на хронічний гастрит - запропонований системою Сіднею. Слід зазначити, що H. pylori Він знаходиться переважно в антральній частині шлунка, за винятком осіб, які отримують ІПП та антигістамінні препарати проти Н2, де в організмі виявляються більш високі показники щільності. Потрібно взяти 5 біопсій таким чином: дві антральні проби з більшої та меншої кривизни, розташовані на від 2 до 3 сантиметрів проксимальніше пілоруса, дві проби з тіла з більшої та меншої кривизни на 8 сантиметрів від дистальної частини кардії та зразок, починаючи з incisura angularis (8). За допомогою цього протоколу бактерії можна виявити практично у всіх інфікованих осіб (9). Взяття біопсії - це практично безболісний процес для пацієнта, але це процедура, яку повинен виконувати фахівець-гастроентеролог, дотримуючись встановлених протоколів медичної етики. Не рекомендується проводити процедуру пацієнтам із виразками, що кровоточать, оскільки це може становити небезпеку кровотечі. Усі дослідження повинні бути схвалені Комітетом з етики та мати чітку інформовану згоду.
Були використані інші шлункові зразки, такі як шлунковий сік, отриманий за допомогою струнного тесту ("струнний тест") та ізоляції від блювоти, забезпечуючи різні результати. H. pylori Її також іноді культивували з позашлункових зразків, таких як зубні відкладення, стравохід, пряма кишка та сечовий міхур.
Аспекти, про які слід пам’ятати: якщо пацієнт проходив лікування антибіотиками, необхідно зачекати принаймні чотири тижні після останньої дози, щоб отримати задовільні результати з точки зору культури. Щипці, за допомогою яких проводиться біопсія, повинні бути адекватно продезінфіковані, щоб уникнути контамінації між пацієнтами; якщо дезінфекція занадто сильна, це може вплинути на життєздатність бактерій.
Зразки для біопсії слід подрібнити або подрібнити у невеликій кількості фізіологічного розчину перед нанесенням на середовище. Однорідну пробу слід негайно покласти на поверхню середовища: її слід взяти ручкою, а потім розподілити по поверхні методом розподілу для ізоляції (8, 9).
Отримані зразки повинні швидко оброблятися, оскільки мікроорганізм дуже чутливий до навколишнього середовища. Зразки біопсії (взяті з антрального відділу та з тіла) повинні бути поміщені в стерильну пробірку з гвинтовою кришкою з 0,5 мл сольового розчину і можуть залишатися там максимум 6 годин. Якщо передбачається затримка, слід використовувати такі транспортні засоби, як середовище Стюарта, і зберігати їх при температурі від 4 до 8 ° C протягом не більше 24 годин перед обробкою, потім гомогенізувати та висівати в двох примірниках у різні культуральні середовища, включаючи бульйон та агар Бруцелла, BHI, Мюллер Хінтон, агар Колумбії та триптиказа сої, як правило, доповнюються фетальною бичачою сироваткою, еритроцитарним лізатом, дріжджовим екстрактом, пептоном та екстрактом ціанобактерій. Кров (коня, баранини, кролика) зазвичай додають від 7 до 10%, а серед антибіотиків, які додають до середовища, є: ванкоміцин, сульфаметоксазол, триметоприм, цефсулодин та поліміксин В. з 20% гліцерином, який зберігається в морозильній камері при -80 ° C або рідкому N2 (10-12).
Корисність і значення врожаю для H. pylori Він полягає в тому, що він може знати його особливості росту, генетичне різноманіття, епідеміологію та можливість визначення стійкості бактерій до антибіотиків, що використовуються в лікуванні (7, 13).
Tersterman et al (2001) описують використання середовища з визначеними субстратами (Hams F-12), яке використовується для культивування клітин ссавців. Для ізоляції H. pylori Були внесені модифікації, які полягали у доповненні його В-циклодекстрином, холестерином та бичачою сироваткою плоду без додавання крові, що робить це середовище дорогим. Використовували традиційний кров’яний агар та біопсію посівного та еталонного штамів H. pylori, отримання зростання в 100% випадків (14).
Joo et al (2010), при створенні тонкошарової рідкої культури для відновлення H. pylori додаванням бульйону Бруцелла У чашках Петрі діаметром 90 мм, до яких вони додали лошадину сироватку, екстракт дріжджів та диметил-бета-циклодекстрин, вони отримали час генерації 3,3 години, вирощуючи цей мікроорганізм експоненціально протягом 28 годин (15).
Стівенсон та співавт. (2000) пропонують альтернативне поживне середовище, базовий компонент якого складається з агару Колумбія та суміші антибіотиків, що інгібують супутнє мікробне навантаження, таких як ванкоміцин, амфотерицин В, триметоприм та цефсулодин. Крім того, він містить кров коня, екстракт м’яса, агар-агар та кукурудзяний крохмаль (16).
При посіві зразків пілоричного відділу антрального відділу та дна шлунка на агар Колумбія з додаванням 7% дефібринованої крові ягняти та селективної добавки DENT (ванкоміцин, триметоприм, амфотерицин В та цефсулодин) було отримано високу специфічність (100%), бактеріологічна культура розглядалася як золотостійкий (17).
Успішне вирощування Хелікобактер вимагає використання свіжої ягнячої або кінської крові в різних використовуваних агарах. Комерційно підготовлені культуральні середовища можуть працювати, але їх свіжість важко перевірити, і вони часто можуть бути занадто старими або занадто сухими, а також не мають відповідних селективних антибіотиків. Після того, як агари підготовлені, їх не слід використовувати негайно, їх слід зберігати у закритих поліетиленових пакетах при температурі 4 ° С не більше 2 - 3 тижнів (7). Вищесказане було підтверджено в наших дослідженнях, підкреслюючи, що використання агару Бруцела, доданого з кров’ю коня (8%), забезпечує краще відновлення порівняно з кров’ю баранини (8%) і що його консервація повинна проводитися при 4 ° C максимальний час - 20 днів.
У дослідженні, проведеному Yepes та співавт. (2008), в якому резистентність H. pylori у пацієнтів з гастроентерологічної служби лікарні Університету Сан Ігнасіо (HUSI) отримані зразки спочатку транспортували у стерильній пробірці з гвинтовим ковпачком і заморожували при -70 ° C протягом не більше 3 тижнів. Згодом зразок розморожували та культивували на агарі. Бруцелла доповнений 5% ягнячої крові та інкубований протягом 5 днів у вологому мікроаерофільному середовищі при температурі 37 ° C (18).
При оцінці альтернативного транспортного середовища, що складається з відвару Мюллера Хінтона, доповненого екстрактом ціанобактерій (MH-CE), і порівняння його із середовищем, відвару Мюллера Хінтона, доповненого телячою сироваткою плоду (MH-FCS), було отримано, що відновлення через 48 годин при кімнатній температурі в MH-CE було вище (p менше або дорівнює 0,005), ніж у MH-FCS. Середовище MH-CE є простим, недорогим і може використовуватися для збереження життєздатності H. pylori та його відновлення після біопсії (19).
Trespalacios et al (2010) виділено та ідентифіковано H. pylori з біоптатів шлунка, які мацерували в 1% розчині активованого вугілля, отримуючи однорідний розчин. Згодом їх висівали в модифіковане середовище Вілкінса-Чалгрена, доповнене ізовіталексом та антибіотиками, які інкубували в анаеробіозі при 37 ° С протягом 4-15 днів, отримуючи 79 ізолятів і представляючи 80% відновлення (20).
Quiroga et al (2005), при культивуванні зразків біопсії, отриманих від пацієнтів із захворюваннями шлунково-кишкового тракту, які були мацеровані в асептичних умовах та вирощені в середовищі H. pylori (Лабораторія М), доповнена 8% кінської сироватки, 1% ізовіталексу та селективної добавки для Кампілобактер (Merck) повідомив про хороші результати у відновленні H. pylori (двадцять один).
Зростання in vitro H. pylori потрібні такі середовища, як бульйон або агар Бруцелла доповнений вітамінами та кінською сироваткою або циклодекстринами. Рідкі середовища зазвичай демонструють повільне зростання. Заміна сироватки або циклодекстринів комерційним розчином холестерину забезпечує оптимальний ріст H. pylori як альтернатива для його відновлення з клінічних зразків (22).
Majalca та співавт. (2001) оцінили базовий середовище GC (гель, шоколад) з 2% ліофілізованим гемоглобіном, агаром Кампілобактер, Агар Касмана, агар Колумбія, агар для інфузії серця мозку, Бруцелла, Агар Мюллера Хінтона та соєвий агар триптикази, всі вони додаються з 7-10% кров’ю коня або баранини, доповненою антимікробними препаратами та з NAD або без (нікотинамід-аденін) у концентрації 15 мкг/мл. Мікроаерофільне середовище було досягнуто за допомогою конвертів, що генерують СО2, та використання трьох таблеток Алказельцер у 10 мл води у закритій пляшці з парафільмом, зі свічкою або без неї. Штами зберігали при -70 ° С з використанням бульйону Бруцелла додавання 10% кінської сироватки, 25% гліцерину та кінської крові, а також бульйону Бруцелла додаючи 10% фетальної бичачої сироватки та 30% гліцерину. Серед отриманих результатів виділяють: оптимальне мікроаерофільне середовище, отримане з трьома таблетками Алказельцер. Живильне середовище, яке показало найкращі результати у відновленні H. pylori відповідав агару Касмана з 7% кінської крові протягом 5-7 днів, а найкраще середовище збереження відповідало бульйону Бруцелла з 2% бичачої сироватки плоду (23).
Чутливість культуральних середовищ різниться залежно від різних змінних: збору, транспортування, зберігання зразка, культурального середовища та умов інкубації. Navarro та співавт. (2007) оцінили екометричний метод для трьох культуральних середовищ: соєвого агару триптикази, агару BHI та агару Бруцелла, до якого додали 5% крові з баранини. Стійкість трьох засобів масової інформації до H. pylori був низьким і корелював з абсолютним індексом зростання (ICA) нижче 2,5, що вказує на те, що всі вони не мають хорошої здатності до відновлення, можливо, через низьку концентрацію крові та відсутність поживних речовин, таких як ізовіталекс (24).
Зростання H. pylori за відсутності сироватки це все ще складно, і деякі харчові потреби були визначені лише частково, оскільки амінокислоти, метали, хлорид натрію для заліза, цинку та магнію мали вирішальне значення для росту; мідь була не потрібна. Ці дані свідчать про це H. pylori і інші Хелікобактер spp не такі вимогливі, як вважалося раніше. Дані також свідчать про те, що описані хімічно середовища можуть спричинити зростання широкого кола Хелікобактер spp, дозволяючи більш детально охарактеризувати його фізіологію та взаємодію з клітинами хазяїна (25).
Макнулті та співавт. (2002) рекомендують використовувати живильне середовище Вілкінса-Чалгрена-Бруцелла, у відновленні H. pylori з біопсій шлунка, що каталогізуються як селективне середовище (26).
Miendje та співавт. (2010) при оцінці трьох селективних середовищ (PYL-bioMérieux, Франція; агар Helicobacter-Beckton Dickinson, E.U та агар Brugman Helicobacter), використаних для відновлення H. pylori при біоптатах шлунка вони не виявили суттєвої різниці щодо кількості колоній та швидкості одужання. Вони спостерігали появу типових колоній, які були ідентифіковані за допомогою плями Грама та біохімічних тестів, таких як каталаза, оксидаза та уреаза (27).
АНТИБІОГРАМА
Для оцінки чутливості H. pylori Порівняно з антибіотиками, еталонний метод, затверджений Інститутом клінічних та лабораторних стандартів (CLSI), відповідає методу розведення антибіотика в агарі (28).
З іншого боку, Британське товариство антимікробної хіміотерапії рекомендує Е-тест (метод епсилометра), який має хорошу кореляцію з еталонним методом (10).
Для тесту на чутливість використовується агар Мюллера Хінтона, доповнений 5% крові ягняти. Інокулюм готують у 0,85% сольовому розчині порівняно з пробіркою №2 за шкалою Мак-Фарланда (1х10 7 до 1х10 8 КУО/мл). Щоб отримати цей посівний матеріал, штам потрібно взяти з 72-годинної субкультури на кров’яному агарі; таким же чином, як альтернатива, з посівів H. pylori Через 2-3 дні інкубації приготуйте суспензію у відварі Бруцелла з урахуванням шкали Макфарланда (1 x 10 8 КУО/мл), які інокулюють на тарілки агаром Мюллера Хінтона з додаванням 10% кінської сироватки та 2% ізовіталексу (20).
Беручи до уваги, що метод розведення агару звичайно не застосовується, а метод Е-тесту є дорогим і що також спостерігаються розбіжності з метронідазолом, Макнулті в 2002 році провів огляд досліджень, в яких проводилася дифузія з диском, рекомендуючи:
Концентрація диска та точки вирізу: для метронідазолу рекомендується використовувати диск з 5 мкг, який вважається стійким, якщо ореол становить 21 мм. У штамів із середньою чутливістю рекомендується метод визначення МІК. Для кларитроміцину використання диска 2 мкг, який вважається стійким, коли немає гало-інгібуючого гало. Диск кларитроміцину на 15 мкг також можна використовувати і вважати стійким, якщо ореол є
- Основні причини раку шлунка Helicobacter pylori, сімейний анамнез, дієта та
- Що ви не знали про хелікобактер пілорі
- ТРАВМА БАКТЕРІЙ HELICOBACTER PYLORI, ЯЗМУ І ГАСТРИТУ, ANM
- Присутність Helicobacter pylori в біопсіях g; стрики та кал хворих на педі; трико з
- Чому рак підшлункової залози такий смертельний?