Нефрологія - офіційне видання Іспанського товариства нефрології. Журнал публікує статті про основні або клінічні дослідження, пов’язані з нефрологією, високим кров’яним тиском, діалізом та трансплантацією нирок. Журнал відповідає положенням системи рецензування, завдяки чому всі оригінальні статті оцінюються як комітетом, так і зовнішніми рецензентами. Журнал приймає статті, написані іспанською або англійською мовами. Нефрологія відповідає стандартам публікацій Міжнародного комітету редакторів медичних журналів (ICMJE) та Комітету з етичних публікацій (COPE).
Індексується у:
MEDLINE, EMBASE, IME, IBEC, Scopus та SCIE/JCR
Слідкуй за нами на:
Фактор впливу вимірює середню кількість цитат, отриманих за рік за твори, опубліковані у виданні протягом попередніх двох років.
CiteScore вимірює середню кількість цитат, отриманих за опубліковану статтю. Читати далі
SJR - це престижна метрика, заснована на ідеї, що всі цитати не рівні. SJR використовує алгоритм, подібний до рейтингу сторінок Google; є кількісним та якісним показником впливу публікації.
SNIP дозволяє порівняти вплив журналів з різних предметних областей, виправляючи відмінності у ймовірності цитування, які існують між журналами різних тем.
Непропорційний життєвий ризик ниркових хворих не може бути віднесений лише до традиційних факторів ризику, але, можливо, також до існування безлічі некласичних факторів ризику, властивих самому захворюванню, таких як анемія, альбумінурія, запалення, окислювальний стрес, недоїдання. інші. В наш час зміни в обміні мінеральних речовин у кістках вважаються важливою складовою цих нетрадиційних факторів ризику і перекриваються з іншими. Таким чином, в обсерваційних дослідженнях рівні кальцію (Ca), фосфору (P), лужної фосфатази (ALP), кальцидіолу, фактора росту фібробластів 23 (FGF-23) та/або паратиреоїдного гормону (PTH) у сироватці крові були пов'язані не тільки з зміни кісток, але також з кальцифікацією серцево-судинних захворювань, артеріальною дисфункцією і, що найважливіше, збільшенням захворюваності та смертності (за даними Block et al. із пов'язаним ризиком 17,5% у хворих на діаліз) 4, навіть незважаючи на те, що остаточної перспективи немає доказ цього. Гіперфосфатемія і особливо збільшення FGF-23 - це параметри, які були найбільш суттєво пов’язані, тобто з вищими відносними ризиками (RR), смертність 4, навіть вище рівня ПТГ, Са або FAL 4, 5 .
Надлишок Р не тільки викликає найважчу форму вторинного гіперпаратиреозу (ГПС), оскільки він є прямим стимулом і блокує всі механізми протирегуляції, але також пов'язаний з іншими позакістковими ефектами, які в підсумку можуть бути пов'язані зі збільшенням смертності ("Тихий" вбивця ") 6. Ці ефекти включають прямі та непрямі наслідки серцево-судинної системи, їх асоціацію з прогресуванням хвороби нирок та центральну роль, яку вона відіграє у кальцифікації коронарних, клапанних та міокардів.
Гіперфосфатемія завжди вважалася важливою, і, крім ниркової остеодистрофії або її впливу на систему серцево-судинної системи, як P, FGF-23, так і Klotho, схоже, відіграють певну роль у явищах, пов'язаних зі старінням, і можуть стати не тільки маркерами, але терапевтичні цілі для поліпшення виживання навіть після ХХН.
ПАТОФІЗІОЛОГІЯ ВТОРИННОГО ГІПЕРПАРАТИРОЇДИЗМУ ТА РАННЕ ВИЗНАЧЕННЯ УТРИМАННЯ ФОСФОРУ
Р є важливим мінералом для земного життя: він бере участь у процесі фосфорилювання білка і є частиною ДНК, а також вторинними передавачами, такими як циклічний АМФ або ГМП. Враховуючи дефіцит фосфатів у природі, організм розробив системи збереження цього мінералу, подібно до того, що відбувається з натрієм для виживання поза водним середовищем. Здається, складніше вирішити проблему надлишку фосфату, характерну для ХХН, але, можливо, через її високу токсичність також були розроблені багаторазові та складні системи елімінації, деякі зайві, такі як існування різних фосфатонінів.
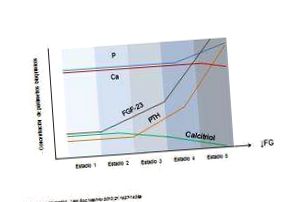
З теорії, розробленої Брикером і Слатопольським в шістдесятих і сімдесятих роках (гіпотеза про інтактний нефрон), ми дізналися, що в міру втрати нефрону решта нефронів змушені пристосовуватися, збільшуючи частку свого виведення 8. Ця ідея відкрила нові галузі досліджень. Стосовно Р, роботи цих авторів вже намалювали взаємозв'язок між клубочковою фільтрацією (ШКФ) та канальцевою реабсорбцією фосфату (РТФ), так що чим нижче СКФ, тим нижчий РТФ і вища частка виділеного Р (ФЕФ) нефроном. У 1970-х рр. В результаті експериментальних досліджень на тваринах і людях було показано, що обмеження Р в раціоні запобігало розвитку ГПС, і центральна роль Р у патогенезі ГПС при ХХН вже була описана в цьому час. Утримання Р як наслідок зменшення ШКФ призведе до зменшення плазми Са, що спричинить вторинне збільшення секреції ПТГ для відновлення рівнів Са та Р. Це добре відома гіпотеза компромісу, для якої початкова користь Компенсація за збільшення ПТГ, що продовжується і продовжується з часом при кожному зниженні ШКФ, призведе до шкідливих наслідків для кістки.
Ісакова та ін. провів дослідження з когортю з 3879 пацієнтів на різних стадіях ХХН та виявив, що вже на дуже ранніх стадіях захворювання (ШКФ 57,8 мл/хв/1,73 м 2, 95% довірчий інтервал 55,4 -60,8), FGF-23 збільшився, навіть до рівня ПТГ, рівня Р або кальцитріолу знижувався. У прошарку пацієнтів із ШКФ між 50-59 мл/хв/1,73 м 2 більше ніж у половини спостерігалося збільшення рівня FGF-23 на відміну від 3% гіперфосфатемії або 22% HPS 13. Це навіть свідчить про можливе використання FGF-23 як раннього маркера змін у кістковому та мінеральному обміні при хронічній хворобі нирок (ХБН-MBD), навіть коли рівні Р все ще нормальні, але затримка Р в організмі вже може початися. при його введенні на ринок такі параметри, як ФЕО, можуть бути використані в клінічній практиці для оцінки наявності перевантаження Р, як рекомендовано керівництвом SEN. 14, до наявності гіперфосфатемії .
Недавні дослідження описують зниження кількості Клото в сечі на дуже ранніх фазах ХХН (стадії 1 і 2), ще до того, як відбувається збільшення FGF-23, пропонуючи його як ранній біомаркер не тільки ХХН-MBD, але й пошкодження нирок 15. Рівні плазми Клото, виміряні за допомогою ІФА, показали дещо заплутані результати щодо зниження рівня ХХН 16. Деякі дослідження на моделях на тваринах досліджували взаємозв'язок Клото з гострою нирковою недостатністю через різну етіологію: ішемічну, обструктивну, в контексті сепсису, гіповолемії або нефротоксичності. Ху та ін. опишіть, як можна виявити зниження рівня білка Klotho у плазмі та сечі через 3 години після пошкодження нирок внаслідок ішемії-реперфузії, навіть до збільшення рівня N-GAL (ліпокалін, пов’язаний з нейтрофільною желатиназою) (5 годин) 17. Наразі нам доведеться зачекати на майбутні дослідження, що підтверджують біохімічні методи, що використовуються в даний час, або досліджують інші з більшою чутливістю.
ВІСНА МАТЧ-FGF-23-KLOTHO І Смерть
Великі ретроспективні дослідження описали гіперфосфатемію як незалежний провісник госпіталізації з причин серцево-судинних захворювань, переломів, раптової смерті, серцево-судинної ситуації та загальної смертності у хворих на діаліз та предіаліз 4,18,19. Блок та ін. проаналізували 40 538 хворих на гемодіаліз і спостерігали, що у пацієнтів із рівнем Р у сироватці від 5–6 мг/дл до 6–7 мг/дл РР відповідно становило 1,07 та 1,25 рази більше, ніж за смертю, ніж у пацієнтів із рівнями від 4–5 мг/дл 4 . Родрігес-Бено та ін. вони також описали в Іспанії, як рівні Р> 5 мг/дл незалежно асоціювались із збільшенням смертності хворих на діаліз 20. Крім того, у першому дослідженні вони спостерігали, як пацієнти, які знаходились у нижчих межах Р (4, ймовірно, пов’язані з недоїданням та/або синдромом МІА (недоїдання-запалення-атероматоз). Таким чином, було висунуто постулат, що контроль рівнів P лише з обмеженням білка може компенсувати перевагу контролю P 21 .
У загальній популяції рівні Р також були пов'язані з ризиком розвитку СС. Навіть рівень фосфатів у верхній межі норми (3,5-4,5 мг/дл) був пов'язаний із підвищеним ризиком серцево-судинних захворювань не тільки у пацієнтів із ХХН 23, але й у пацієнтів без ХХН із серцевим нападом, що передував міокарду (ГІМ) 18. У пацієнтів із підозрою на ішемічну хворобу та збереження функції нирок рівень Р асоціюється з кальцифікацією та ішемічною хворобою 24, а при високих рівнях, але в межах норми, Р також асоціюється із прогресуванням кальцифікації коронарних артерій 25 .
ФОСФОР-FGF-23-KLOTHO ВІС І СУДИННА КАЛИФІКАЦІЯ
На додаток до зазначених вище механізмів, кальцифікація, судячи з усього, суттєво сприяє ризику розвитку СС. Це дуже поширене захворювання на ХХН, удвічі більше, ніж у загальній популяції на ранніх стадіях, і до 9 разів більше на поширених стадіях. Усе це в даний час робить уремічну модель тварини парадигмою для вивчення кальцифікації судин, яку можна поширити на інші спеціальності в області CV.
Класично вважається, що існують два типи кальцифікацій, залежно від місця відкладення корисних копалин, кальцифікація інтими та медіалу, обидва присутні при ХХН. Кальцифікація інтими пов’язана з процесами атеросклерозу (наліт атероми) і знаходиться переважно в коронарних артеріях, збільшуючи ризик ішемії, ерозії та розриву нальоту. Медіальна кальцифікація, пов’язана з процесами артеріосклерозу, розташована головним чином в артеріях, що мають більший збіг (еластичні артерії), і є причиною жорсткості артерій та підвищення пульсового тиску, що часто спостерігається у пацієнтів з ХХН. Ці гемодинамічні зміни призводять до ГСН, порушеного коронарного наповнення та тривалої серцевої недостатності.
Як ми бачили, P сприяє кальцифікації судин, сприяючи також утворенню ядер кристалів біоапатиту. Проходження Р в клітину здійснюється через Na-P котранспортери (NTP). NTP-III (Pit-1 та Pit-2) експресується в клітинах гладкої мускулатури (Pit-1> Pit-2). Р перетинає мембрану через Яму-1 і потрапляючи всередину, індукує утворення мінералізуючих пухирців та остеохондрогенну фенотипічну трансформацію. Не можна забувати про значення Ca і про те, що деякі автори, такі як Ян та ін. продемонстрував, що Са також регулює експресію Піт-1, виробляючи синергетичний прокальцифікуючий ефект разом з гіперфосфатемією 38. Подібним чином експериментальні дослідження in vivo показали, як ацидоз може зменшити кальцифікацію м’яких тканин 39 .
Також при кальцифілаксії (кальцифікуюча уремічна артеріолопатія), патології з високим рівнем смертності, гіперфосфатемія буде спричинена індукуванням кальцифікації артеріол, помножуючи ризик на 3,5 на кожне збільшення сироватки P 40 на 1 мг/дл .
ОСІ ФОСФОР-FGF-23-КЛОТО, ЗАПАЛЕННЯ ТА ОКСИДАТИВНИЙ СТРЕС
За останні десятиліття атеросклеротичний процес перетворився із чисто метаболічного на набагато складніший, включаючи запальні явища. Запалення є загальним станом при ХХН, особливо на термінальних стадіях захворювання (> 50% пацієнтів), що може частково сприяти виправданню високого ризику серцево-судинних захворювань, який представляють ці пацієнти. Різні фактори, такі як генетичне навантаження, окислювальний стрес, знижений кліренс прозапальних цитокінів (таких як TNF-α, IL-6) або вегетативна дисфункція, можуть сприяти запальному стану при ХХН.
Р бере участь у регуляції багатьох запальних шляхів через процеси фосфорилювання, ось чому деякі автори припускають, що гіперфосфатемія може безпосередньо активувати запальний каскад 41. У цьому сенсі Наварро та ін. опублікував елегантне дослідження у пацієнтів із ХХН на стадії 3-4 без анамнезу серцево-судинної хвороби або лікування препаратами кальцію, хелаторами Р або вітаміном D та відзначив, що рівні ультрачутливого CRP (C-реактивного білка) та IL-6 були вищими у пацієнтів з Р ≥ 5 мг/дл (с 42 .
Р є одним із субстратів окисного фосфорилювання та відіграє важливу роль у регуляції потенціалу мітохондріальної мембрани та виробленні супероксидних радикалів. P після потрапляння в клітину через Pit-1 стимулював би вироблення супероксидних радикалів, які активували б шлях NFκB, який після транслокації в ядро (через p65) зв’язувався б із специфічними послідовностями ДНК для транскрипції програм остеогенного 43. Окислювальний стрес може збільшити транскрипцію RunX2 та MsX2, серед інших факторів мінералізації судин 43,44 .
Щодо запалення, деякі альтернативні ферментативні дії Клото до його трансмембранної версії також були описані як кофактор сигналізації FGF-23. Таким чином, циркулююча форма Клото (що належить до сімейства β-глікозидаз) діє як гуморальний фактор, інгібуючи внутрішньоклітинні сигнальні каскади, такі як інсулін/інсуліноподібний фактор росту 1, та інші шляхи, які, як наслідок, утворюють радикали які сприяють клітинному старінню 45. Таким чином, Клото, збільшуючи стійкість до окисного стресу, може збільшити тривалість життя деяких видів.
PHOSPHORUS-FGF-23-KLOTHO ОСІ ТА ХВОРОБИ НИРКИ
Р може сприяти розвитку ХЗН за допомогою механізмів, які ще недостатньо добре зрозумілі. Деякі автори постулюють гіпотезу кальцифікації опадів, засновану на відкладанні кристалів фосфату кальцію в трубчастих та інтерстиціальних клітинах, що спричинює пошкодження клітин та проліферацію фібробластів. Також відомо, що перевантаження Р пошкоджує подоцит у експериментальних тварин, що може пояснити зв'язок, описаний між Р і ступенем тяжкості протеїнурії. У цьому сенсі останні дослідження описують, як дієта, багата на Р, пов'язана із збільшенням ниркової експресії перетворюючого фермент ангіотензину у нефректомізованих щурів, збільшуючи пошкодження тканин.
У людини 331 пацієнт з протеїнурією та ХХН ретроспективно проаналізовано у дослідженні REIN, спостерігаючи, що антипротеїнуричний ефект раміприлу значно ослаблений із збільшенням рівня Р 46. У загальній популяції навіть було описано, що рівні Р у верхньому квартилі нормальності незалежно пов'язані з наявністю мікроальбумінурії.
Так само Каравака та співавт. вони також спостерігали, як існувала лінійна кореляція між варіацією ШКФ та Р в сироватці крові у пацієнтів із запущеною ХХН. У цьому ж дослідженні було помічено, що пацієнти, які отримували діуретики, демонстрували значно вищу середню концентрацію Р у сироватці крові. Інші автори описують, що при кожному збільшенні Р у мг/дл СКФ значно зменшується на 0,154 мл/хв/місяць 48. У попередньому дослідженні було відзначено, що швидкість погіршення функції нирок тим інтенсивніша, чим вище була вихідна залишкова функція нирок, що свідчить про те, що Р міг би відігравати незалежну роль у прогресуванні ХХН 47.
FGF-23 також може бути новим маркером ниркової прогресії, на що вказують деякі дослідження, де було виявлено, що існує зворотна кореляція між його рівнями та зниженням ШКФ. Інші автори припускають, що поєднання підвищеного рівня FGF-23 із зниженим рівнем кальцидіолу забезпечує найкращу стратифікацію ризику прогресування ниркової функції. Однак у пацієнтів із запущеною ХХН (ШКФ 2) взаємозв'язок між FGF-23 та кінцевою ХХН втрачається при коригуванні на ШКФ, оскільки остання є головною детермінантою прогресування ХХН. Потрібні подальші дослідження, щоб з'ясувати, чи діє FGF-23 як біомаркер ХХН або має прямий механізм прогресування захворювання. Як згадувалося раніше, також було описано, що Клото може виконувати ренопротекторну роль, як пропонують деякі експериментальні дослідження, зменшуючи апоптоз при гострій нирковій недостатності ішемічного походження.
FEDER RETIC REDINREN Фонди FIS RD12/0021.
Конфлікт інтересів
Автори заявляють, що у них немає потенційних конфліктів інтересів, пов'язаних зі змістом цієї статті.
- Роль вітаміну D в обструктивній хворобі легенів cr; унікальний; астма та інші захворювання
- Нові стратегії терапії; Застосування при гепатитах С та В у пацієнтів із захворюваннями нирок
- Різдвяне меню; Хрестить із вами при хворобі нирок
- Білки в дієті та хронічна хвороба нирок - Білкова та фосфорна їжа - DaVita
- 8 найпоширеніших симптомів захворювання нирок - краще зі здоров’ям