реферат
Цей огляд постулює та подає останні докази того, що резистентність до інсуліну ініціюється в жировій тканині, а також припускає, що жирова тканина може відігравати ключову роль у стимулюванні інсулінорезистентності в м’язах та печінці. У жирових клітинах пацієнтів з діабетом 2 типу спостерігаються значні порушення у внутрішньоклітинному каскаді передачі інсуліну, включаючи знижену експресію гена IRS-1 та білка, порушення стимульованої інсуліном активності PI3-кінази та активності PKB/Akt. На відміну від цього, передача сигналу інсуліну в скелетних м’язах у хворих на цукровий діабет демонструє лише легкі пошкодження, і активація інсуліну PKB/Akt in vivo здається нормальною. Однак стимульований інсуліном транспорт глюкози та синтез глікогену значно зменшуються.
Подібні помітні порушення в передачі сигналів інсуліну, включаючи зниження експресії IRS-1, порушення стимульованої інсуліном активності PI3-кінази та активності PKB/Akt також спостерігаються у деяких (~ 30%) нормоглікемічних осіб з генетичною схильністю до діабету 2 типу. GLUT4 значно зменшується в цих клітинах, що схоже на ті, що спостерігаються в клітинах діабету. Особи із зниженою клітинною експресією IRS-1 та GLUT4 також помітно стійкі до інсуліну та демонструють кілька характеристик синдрому інсулінорезистентності.
Таким чином, у жирових клітинах у нормоглікемічних суб’єктів спостерігається також «діабетичний» характер, що пов’язано з вираженою резистентністю до інсуліну in vivo. Існує думка, що інсулінорезистентність та/або його ефектори ініціюються в адипоцитах, і це може бути вторинним щодо інших цільових тканин інсуліну, включаючи порушення транспорту глюкози в м’язах.
Оцінка чутливості всього організму до інсуліну та ефекту евглікемічного методу в основному є відображенням розпаду глюкози м’язами (60–70%). Жирова тканина становить лише 10% від загального поглинання глюкози у всьому тілі, а печінка - 30%. Знижений кліренс глюкози, стимульований інсуліном під час еуглікемічного затиску, в основному пов’язаний із зменшенням споживання глюкози в м’язах. Це призвело до екстраполяції того, що резистентність до інсуліну у всьому тілі відбувається не тільки в м’язах, але і в м’язах. Це невиправдана екстраполяція, яка може призвести до неправильного пошуку патогенних механізмів.
Моделі тварин, як трансгенна надмірна експресія, так і генетичні нокаути, дали нам захоплююче розуміння фенотипових наслідків надмірної експресії або абляції конкретних генів. Абляція генами важливих стикувальних білків IRS-1 та IRS-2 призвела до уповільнення росту та помітно стійкого до інсуліну (IRS-1) 2 або інсулінорезистентних та діабетичних тварин із порушеннями секреції інсуліну (IRS-2). 3 Специфічна для м’язів абляція GLUT4 призводить до інсулінорезистентності4, але подібно до генокотичного глют4-специфічного нокауту, фактично до того, що здається схожим. Цей висновок явно не узгоджується з важливою роллю жирової тканини у виведенні глюкози з організму. Ще однією цікавою знахідкою на моделях тварин є те, що виснаження м’язів GLUT4 пов’язане з помітним збільшенням споживання глюкози та збільшенням маси жирової тканини. Цей міжтканинний зв’язок підтримує можливість того, що резистентність до інсуліну може бути ініційована в одній тканині з наступною низкою подій в інших тканинах/органах.
Цей короткий огляд підсумовує наші останні результати у людей, які показують, що резистентність до інсуліну та порушення дії інсуліну спочатку відбуваються в жировій тканині; насправді задовго до того, як розвивається непереносимість глюкози. Потім припускають, що жирова тканина може ініціювати та/або бути початковим органом-мішенню для інсуліну, де розвивається резистентність до інсуліну. Будуть вивчені останні дані, де вивчали передачу сигналу та вплив інсуліну в тканинах-мішенях людини в умовах, стійких до інсуліну, особливо при діабеті 2 типу. Оскільки про передачу сигналів інсуліну за рецептором інсуліну в печінці людини практично нічого не відомо, порівняння можна проводити лише між скелетними м’язами та жировими клітинами.
Діабет 2 типу
Нещодавно досліджували вплив інсуліну, введеного in vivo або доданого in vitro, на транспорт глюкози та передачу сигналів інсуліну в скелетних м’язах у пацієнтів з діабетом 2 типу. Найбільш значущими виявляються порушення стимульованого тирозином стимульованого інсуліном фосфорилювання IRS-1, що пов’язано із зниженням активності PI3-кінази на 50%. Однак подальша активація важливої серин/треонінкінази PKB/Akt здається нормальною 8 або лише у присутності надзвичайної концентрації інсуліну, доданого in vitro. Порушення фосфорилювання тирозину, здається, не зумовлене зниженням експресії білка IRS-1, хоча в деяких клітинах спостерігався нижчий рівень гестаційного діабету. Посилене фосфорилювання серину IRS-1 може зменшити стимульоване інсуліном фосфорилювання тирозину, але наразі невідомо, чи це стосується діабету типу 2. Загалом, дані свідчать про те, що активація PI3-кінази і, можливо, PI3, 4- та фосфатна генерація PI3, 4, 5, зменшується, але все ще є достатнім для нормальної активації нижніх подій сигналізації. Це призвело до висновку, що резистентність до інсуліну в скелетних м’язах зумовлена порушенням активації ефекторних або сигнальних молекул PKB/Akt. 8
Транспорт глюкози, стимульований інсуліном, також зменшується в скелетних м’язах у пацієнтів з діабетом типу 2. 12 Однак, як не дивно, недавні дослідження in vitro показали, що це, головним чином, пов’язано з „токсичністю глюкози”. Попередня інкубація біоптатів тканин протягом лише 2 годин при високому рівні глюкози погіршує дію інсуліну 13, тоді як попередня інкубація м’язів діабетичних м’язів протягом 2 годин при фізіологічному рівні глюкози нормалізує відповідь на інсулін. Однак можливо також, що час попередньої інкубації перевищує вплив інших циркулюючих антагоністів на дію інсуліну, таких як TNFα, інтерлейкіни та/або вільні жирні кислоти (FFA). Наявні в даний час дані свідчать про те, що у пацієнтів із діабетом 2 типу у скелетних м’язах спостерігаються лише помірні та, мабуть, функціонально не критичні розлади при передачі сигналів інсуліну до PKB/Akt. Крім того, стимульований інсуліном перенос глюкози здається швидко оборотним in vitro шляхом попередньої інкубації зразків тканин у свіжому середовищі, що містить фізіологічну глюкозу. Ці висновки також узгоджуються з послідовними доказами того, що як вміст білка GLUT4, так і експресія мРНК є нормальними для скелетних м’язів при цукровому діабеті 2 типу. 7, 16
Зовсім інша ситуація спостерігається у жировій тканині. Адипоцити пацієнтів з діабетом 2 типу також мають значне зниження IRS-1-стимульованого фосфорилювання тирозину. Однак це в основному пов'язано з вираженням на 70% зниження експресії білка IRS-1. Подібним чином загальна активність PI3-кінази знижується на 70%. На відміну від цього, експресія IRS-2 є нормальною, і ця молекула також стає основним стикуючим білком для стимульованої інсуліном активації PI3-кінази. 17 Відповідно до зниженої активації PI3-кінази, активація PKB/Akt нижче за течією також значно зменшується, головним чином, завдяки значному зменшенню стимульованого інсуліном фосфорилювання серину. Транспорт глюкози у відповідь на інсулін також знижується в жирових клітинах пацієнтів з діабетом 2 типу через порушення сигналізації інсуліну, а також помітне зниження (∼ 70–80%) білка GLUT4 та експресії мРНК. 17, 19, 20
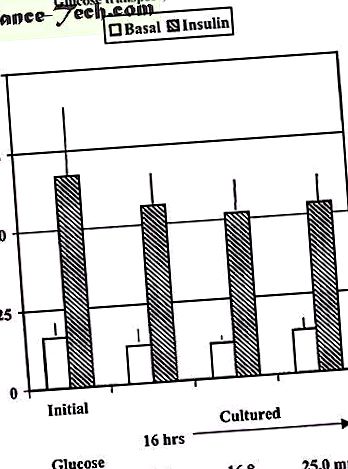
На відміну від м’язових клітин, як зазначалося вище, попередня інкубація жирових клітин людини протягом 16 годин при фізіологічних (5,6 ммоль/л) або високих концентраціях глюкози (16, 8 і 25 ммоль/л) не перешкоджає гострому стимулюючому впливу інсуліну на глюкозу (рис. 1), а також попередня інкубація клітин діабету при фізіологічних концентраціях глюкози не відновлює гостру реакцію інсуліну через 6 годин (неопубліковані спостереження). Це узгоджується зі зменшенням експресії білка GLUT4 в адипоцитах, що, ймовірно, потребуватиме довшого часу звороту.
Поглинання глюкози експлантатами підшкірної жирової тканини людини до (початкового) або після культивування протягом 16 годин при 5, 6, 16, 7 або 25,0 мМ глюкози. Після періоду культивування виділені клітини інкубували з 6,9 нМ інсуліну та 0,15 uCi [14CU] глюкози протягом 60 хвилин для визначення поглинання глюкози. Дані є середніми ± sem чотирьох окремих експериментів.
Повнорозмірне зображення
У таблиці 1 узагальнено основні відмінності висхідних стимульованих інсуліном подій у м’язах та жирі у пацієнтів із діабетом 2 типу порівняно з пацієнтами без діабету.
Стіл в натуральну величину
Нормоглікемічні, резистентні до інсуліну стани
Експресія білка IRS-1 у жирових клітинах людей із ожирінням або здорових родичів діабету 2 типу, які не страждають ожирінням. Дані відтворені з Carvalho et al. 28 з дозволу.
Повнорозмірне зображення
Таким чином, низька експресія генів і білків IRS-1 та GLUT4 спостерігається в жирових клітинах пацієнтів з діабетом 2 типу, а також у групі здорових людей, особливо тих, хто має сильний спадковий діабет типу 2. У цих групах нижче за течією події сигналізації також впливають аналогічно для інсуліну. Здорові особи з цими клітинними аномаліями також помітно стійкі до інсуліну in vivo, мають вищий рівень інсуліну натще і тригліцеридів, що демонструє кілька ознак синдрому резистентності до інсуліну (або метаболізму). Крім того, той факт, що ці особи були стійкі до здатності інсуліну стимулювати засвоєння глюкози in vivo під час еуглікемічного затиску, свідчить про те, що всмоктування м’язів було зменшено, ймовірно, через порушення транспорту глюкози. 34
Навряд чи молекулярні відхилення, що спостерігаються в жирових клітинах, є вторинними щодо резистентності до інсуліну та гіперінсулінемії. Хоча білок IRS-1 може бути знижений за допомогою тривалої та вираженої гіперінсулінемії in vitro, у 35 людей із ожирінням спостерігалася як гіперінсулінемія, так і нормальна експресія IRS-1. Зменшення виразу GLUT4 неможливо пояснити цією можливістю.
Як уже згадувалося вище, головним послідовним виявленням у м’язах при цукровому діабеті 2 типу є порушення (швидко зворотне?) У стимульованому інсуліном транспорті глюкози та синтезі глікогену, тоді як активація PKB/Akt є нормальною. Хоча це не виключає серйозних відхилень в інших, досі невизначених молекулярних цілях дії інсуліну в м'язах, таких як c-Cbl-асоційований білок (CAP), 36 також очевидно, що в цьому є великі відмінності між жиром та м'язами уваги. Таким чином, низька експресія IRS-1 в адипоцитах є біомаркером інсулінорезистентності та схильністю до діабету 2 типу. 28
Тоді ключове питання полягає в тому, чому існують ці відмінності в сигналізації інсуліну та експресії генів та білків між двома основними тканинами-мішенями інсуліну. Хоча на це немає твердих відповідей, одна з можливостей полягає в тому, що жирова тканина ініціює та/або є початковою тканиною, де розвивається резистентність до інсуліну. Потім це може призвести до низки подій, коли в м’язах та печінці індукується або підвищується резистентність до інсуліну.
Однією з можливостей є те, що знижена експресія IRS-1 та GLUT4 у жирових клітинах призводить до зниження чутливості до інсуліну у всьому тілі. Як зазначалося вище, малоймовірно, що зменшення відносно низького споживання жирової глюкози (
Нещодавно було виявлено, що жирова тканина виділяє інший пептид, резистин 40, який може бути пов’язаний з резистентністю до інсуліну при ожирінні. Подібний білок, званий FIZZ141, раніше був виділений із запальних клітин при промиванні легенів у тварин з експериментально індукованою астмою. Однак загальна роль резистину в резистентності до інсуліну людини є гіпотезичною. Два останніх дослідження не змогли виявити експресію резистину в жирових клітинах 42, 43 людини незалежно від ступеня ожиріння 42 або резистентності до інсуліну. 43
Інша можливість полягає в тому, що низька експресія IRS-1 та GLUT4 в адипоцитах пов’язана з підвищеним рівнем ліполізу та циркулюючої FFA, що, у свою чергу, погіршує дію інсуліну in vivo. Однак рівень FFA натще у цих осіб не відрізняється від рівня ретельно підібраних осіб з нормальною експресією цих білків, однак, як очікується, здатність інсуліну знижувати рівень FFA.
Незважаючи на те, що існує багато доказів, що підтверджують ендокринну перехресну передачу між жиром та м’язами (та печінкою?), Наразі незрозуміло, яким чином такий механізм може пояснити той факт, що ліпоатрофія також пов’язана з інсулінорезистентністю та діабетом. В одній тваринній моделі ліпоатрофії виявлено, що резистентність до інсуліну, ймовірно, зумовлена дефіцитом лептину. Введення лептину цим тваринам значно покращило чутливість до інсуліну, мабуть, через посилене окислення надлишків накопичених ліпідів у м’язах та інших тканинах. На відміну від цього, в іншій тваринній моделі загальної ліпоатрофії лептин не зміг покращити резистентність до інсуліну, проте трансплантація жиру призвела до значного поліпшення. 46
Таким чином, жирова тканина не тільки виробляє пептиди, які можуть викликати резистентність до інсуліну, але також гормони, які можуть підвищити резистентність до інсуліну, такі як лептин 45 та адипонектин. 47, 48, 49 Рівень адипонектину в циркуляції позитивно корелює з чутливістю до інсуліну і негативно пов'язаний з ІМТ. Крім того, введення адипонектину на тваринні моделі інсулінорезистентності та діабету покращує чутливість до інсуліну. Таким чином, баланс вироблення гормонів жирової тканини, який посилює (наприклад, IL-6 і TNFα) або полегшує (наприклад, лептин та адипонектин) резистентність до інсуліну, а також інші ефекти, ймовірно, обумовлені кількома факторами, включаючи жирову масу, поживність статус та генетичне походження.
Вплив тіазолідиндіонів на експресію IRS-1 та IRS-2
Вплив піоглітазону (10 мкМ) на експресію мРНК IRS-2 в жирових клітинах адипоцитів типу 2, інкубованих протягом 16 годин, як зазначено.
Повнорозмірне зображення
IRS-2 є основним стикуючим білком для активації PI3-кінази в адипоцитах, коли IRS-1 помітно знижений, як при діабеті 2, 17 типу, як описано вище. Подібним чином IRS-2 функціонує як основний стикувальний білок у клітинах тварин, що вибиваються з IRS-1. Крім того, IRS-2, здається, є переважною молекулою IRS, що експресується в печінці та β-клітинах 3, 53, а аномалії в цих органах також, як видається, є основною причиною діабету 2 типу у збивання тварин з IRS-2. Нещодавно ми досліджували клітинні рівні IRS-2 у тварин об/об, які отримували TZD протягом 6 днів, а також виявили підвищену експресію в жирових клітинах (неопубліковане спостереження). Однак наразі незрозуміло, чи збільшує TZD також експресію IRS-2 у м'язах, печінці та β-клітинах, але це є предметом постійного дослідження.
Підвищена експресія IRS-2 у жирі, печінці та/або м’язах може замінити зниження білка IRS-1 та/або порушення фосфорилювання та активації інсуліну, що призведе до підвищення чутливості до інсуліну. Крім того, передбачуване збільшення експресії IRS-2 у β-клітинах за допомогою TZD може бути важливим як для росту, так і для функціонування. Однак представляється привабливим терапевтичним варіантом наявність засобів, які безпосередньо збільшують експресію IRS-1, оскільки цей стикуючий білок є основним активатором PI3-кінази у відповідь на інсулін в людських адипоцитах і, на відміну від IRS-2, стійкий до IRS-1.Інсулін значно знижений в адипоцитах. Тут ми припускаємо, що специфічне для тканини зниження експресії гена та білка IRS-1 та GLUT4 може відігравати важливу роль у розвитку резистентності до всього інсуліну безпосередньо чи опосередковано через асоціацію з підвищеною продукцією цитокінів та/або іншими факторами-антагоністами інсуліну. (Малюнок 4). TZD може послабити або нормалізувати цей ефект за рахунок збільшення експресії IRS-2 в адипоцитах та, можливо, інших тканинах-мішенях щодо інсуліну та β-клітин підшлункової залози.
Потенційна послідовність подій, при яких жирова тканина може викликати резистентність до інсуліну.
Повнорозмірне зображення
Незважаючи на те, що цей огляд зосереджений на останніх дослідженнях щодо резистентності до інсуліну до ранніх порушень сигналізації та дії інсуліну в адипоцитах через зниження експресії IRS-1/GLUT4 та впливу TZD на IRS-1/IRS-2, TZD, очевидно, також спричиняє інші важливі зміни. в жировій тканині. Сюди входить набір нових і менших адипоцитів через посилений адипогенез, процес, в якому як IRS-1, так і IRS-2 відіграють вирішальну роль, 56 змінюючи експресію генів, прямо чи опосередковано пов'язану з дією інсуліну, 57 включаючи інгібування цитокінами вивільнення адипоцитів. Крім того, здатність TNFα стимулювати ліполіз та вивільнення FFA також протидіє TZD. 38
Однак інсулін є ключовим регулятором рівня ліполізу та рівня циркулюючої жирної кислоти in vivo, а антиліполітичний ефект інсуліну опосередковується активацією PI3-кінази. Таким чином, знижена експресія IRS-1 та стимульована інсуліном активність PI3-кінази також буде пов'язувати резистентність до інсуліну, як це визначено зниженим споживанням інсуліну, що поглинається, з порушеною здатністю інсуліну пригнічувати ліполіз.
Дякую
Дослідження, проведені в лабораторії автора, були підтримані грантами Шведської ради з медичних досліджень (проект B-3506), Шведської асоціації діабетиків, Європейського співтовариства (QLG1-CT-1999-00674), Гуллана та Свена-Еріка Карлссона, Фонду пам'яті Sony Hedenbratt та Фонду IngaBritt та Arne Lundberg.
- Трансформація нової дружини Коллара 6 років тому він би не спіткнувся про неї, ось як вона виглядала без мегапієрів
- Слідкуйте за гарячою плитою, гострими ножами та падіннями 13 важливих порад, як захистити дітей від травм
- Панічний розлад і пологи
- Політик; бічна атака; і в т.ч. зиу дет; кол; k; Раніше; кол; k
- Гострий перець захищає від серцевого нападу - Людина - Наука і техніка