Осмос дуже важливий процес як на хімічному, так і на біологічному рівні.
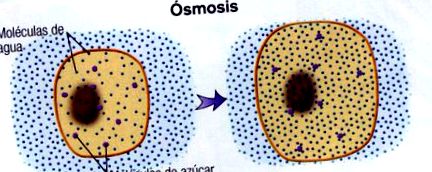
Але, Що таке осмос? Осмос - явище, при якому проходження або дифузія розчинника відбувається через напівпроникну мембрану, що дозволяє проходити розчиннику, але не розчиненій речовині, з більш розведеного розчину в більш концентрований.
Здатність води проходити через плазматичну мембрану, яка поводиться як напівпроникна мембрана, залежить від різниці концентрацій між позаклітинною та внутрішньоклітинною рідинами і визначається наявністю мінеральних солей та розчинених органічних молекул.
Водні середовища, розділені напівпроникними мембранами, можуть мати різну концентрацію і називаються:
- Гіпертонічна, ті з високою концентрацією розчинених речовин порівняно з іншими, у яких концентрація нижча.
- Гіпотонічний, ті, що містять низьку концентрацію розчинених речовин порівняно з іншими, які мають її вищу.
Молекули води дифундують від гіпотонічного до гіпертонічного середовища, викликаючи збільшення тиску на мембрану гіпотонічного відсіку, що називається осмотичний тиск. Як наслідок осмотичного процесу можна досягти рівноваги, вирівнюючи концентрації, і тоді середовище буде ізотонічний, тобто вони мають однакову концентрацію.
Осмос на кухні
Ми не знаємо, але ми можемо побачити осмос на своїй кухні: коли ми варимо макарони або рис, коли готуємо зморшкувату картоплю, коли замочуємо листя салату або бобові
Якщо ми помістимо сухий лист салату у воду, він за кілька годин відновить всю свою структуру. Салат втратив воду і відновлює її завдяки осмосу.
Дуже простий експеримент для демонстрації цього факту можна провести з двома курячими яйцями, оцтом і двома розчинами: один з високою концентрацією в деякій кількості розчиненої речовини (наприклад, солі), а інший лише з дистильованою водою.
Як ми можемо побачити в експерименті, яйце, яке знаходиться у дуже концентрованому розчині солі (гіпертонічна), прагне вигнати воду, стаючи більш зморшкуватою, тоді як коли вона знаходиться в дистильованій воді (гіпотонічний розчин), вона надувається. Той самий експеримент можна провести, протестувавши різні концентровані розчини з розчиненими речовинами, більшими за сіль, і спостерігаючи ефект більш різким способом (наприклад, з глюкозним сиропом або цукром).
Гідростатичний тиск, який вода чинить для входу або виходу, називається осмотичним тиском і регулюється концентрацією та температурою.
Що станеться з нашими клітинами?
На наступних відео ви можете побачити еритроцити у гіпертонічному розчині та у гіпотонічному розчині. Коли еритроцити знаходяться в гіпертонічному розчині, для вирівнювання концентрації вони виділяють воду, залишаючись «сухою», що спричиняє їх загибель.
Коли розчинення є гіпотонічним, еритроцити, як правило, забирають воду і набрякають, іноді спричиняючи розпад клітин або лізис.
Наступні зображення показують результат наступного досвіду:
Еритроцити однієї людини вводили у трьох різних розчинах:
- Ізотонічний. Еритроцити осідали в контейнері, що містив сироватку крові.
- Гіпотонічний Еритроцити вводили в ємність із плазмою крові, розведеною водою.
- Гіпертонічна Еритроцити поміщали в ємність із плазмою крові, до якої додавали концентрований розчин NaCl.