Перегляньте статті та зміст, опубліковані в цьому носії, а також електронні зведення наукових журналів на момент публікації
Будьте в курсі завжди, завдяки попередженням та новинам
Доступ до ексклюзивних рекламних акцій на підписки, запуски та акредитовані курси
Семінари Іспанського фонду ревматології - це молодий та динамічний журнал, створений з метою проведення оглядів ревматичних захворювань: системних захворювань, запальних артропатій, захворювань кісток та ревматизму м’яких тканин. Аналогічно, він охоплює аспекти інших прикордонних областей спеціальності. Видання є органом безперервної освіти Іспанського товариства ревматологів і виходить щокварталу. Структура журналу складається з редакційної та п'яти замовлених оглядів, що представляють великий інтерес для фахівців за цією спеціальністю. Семінари Іспанського фонду ревматології - це публікація par excellence про безперервну освіту Держкомрегіональної освіти, яка має схвалення Іспанської системи акредитації безперервної освіти (SEAFORMEC).
Слідкуй за нами на:
SJR - це престижна метрика, заснована на ідеї, що всі цитати не рівні. SJR використовує алгоритм, подібний до рейтингу сторінок Google; є кількісним та якісним показником впливу публікації.
SNIP дозволяє порівняти вплив журналів з різних предметних областей, виправляючи відмінності у ймовірності цитування, які існують між журналами різних тем.
- Резюме
- Ключові слова
- Анотація
- Ключові слова
- Вступ
- Резюме
- Ключові слова
- Анотація
- Ключові слова
- Вступ
- Етіологія
- Запальне явище
- Дегенеративне явище
- Мітохондріальне явище
- Клінічні прояви
- Лабораторія
- Електронейроміографія
- МРТ м’язів
- М’язова патологія
- Діагностика
- Диференціальна діагностика
- Прогноз
- Лікування
- Кортикостероїди
- Імунодепресанти
- Внутрішньовенні імуноглобуліни
- Біологічні агенти
- Симптоматична терапія
- Інші методи лікування
- Конфлікт інтересів
- Бібліографія
Міозит спорадичного включення тіла (ІВМ) є основною підгрупою серед ідіопатичних запальних міопатій. Клінічні та патологічні дані цього захворювання чітко визначені, але їх не завжди легко визначити. В основному IBM вражає чоловіків віком понад 50 років, які зазвичай мають хронічну, а іноді асиметричну слабкість та атрофію, що вимагає широкого диференціального діагнозу. Деякі добре охарактеризовані аутоімунні захворювання пов'язані з ІВМ. Однак, на відміну від дерматоміозиту, немає жодних зв’язків з неопластичними захворюваннями. Клінічні та гістопатологічні дані є обов’язковими для діагностики ІВМ, тоді як лабораторні та електроміографічні дослідження, як правило, недіагностичні. Навпаки, магнітно-резонансна томографія може допомогти в діагностиці і, можливо, повинна бути включена в діагностичні критерії. Патогенез ІВМ все ще недостатньо чітко визначений, оскільки він включає взаємозв'язок запальних, дегенеративних та мітохондріальних явищ. Затримка діагностики є правилом, і реакція на доступні методи лікування є поганою, за винятком випадків, коли аутоімунне захворювання асоціюється з IBM.
Міозит інклюзійного тіла (ІКМ) у його спорадичній формі був описаний як патологічна сутність в 1971 р. Юнісом та Самахою 1 і входить до групи ідіопатичних запальних міопатій (ІІМ) разом з дерматоміозитом (ДМ), поліміозитом (ПМ) та імуно- опосередкована або аутоімунна некротизуюча міопатія (ANM) 2. IIM складають гетерогенну групу набутих міопатій, які мають спільну присутність гострої, підгострої або хронічної м’язової слабкості та гістологічних ознак запалення. Останній, наявність запального інфільтрату в біопсії м’язів, є найбільш актуальною гістологічною зміною, яка відрізняє спорадичну ВМК від її спадкової форми. .
На відміну від решти MII, MCI має схильність до чоловічої статі та похилого віку і є найпоширенішою набутою міопатією у людей старше 50 років. Етіологія його невідома, а патогенез дуже складний, поєднуючи імунно-опосередковані, дегенеративні та мітохондріальні запальні явища 6–11 .
Клінічно вона характеризується часто асиметричною слабкістю м’язів, переважно дистальною у верхніх кінцівках та проксимальною у нижніх кінцівках, а також може бути пов’язана з порушеннями ковтання. Він прогресує повільно, створюючи помітну захворюваність та функціональну залежність, обмежуючи пацієнтів користуватися інвалідним візком приблизно через 10 років після появи симптомів 8 .
На жаль, переважна більшість випадків ІКМ не є стійким до лікування, тому розробка нових методів лікування, заснованих на поглибленні його патогенетичних механізмів, є суттєвою для покращення якості та тривалості життя цих пацієнтів 6,12,13 .
У 1967 році Chou 14 описав, що, мабуть, буде першим задокументованим випадком ICM, і роками пізніше Yunis і Samaha 1 ввели термін ICM, описуючи його як нозологічну сутність. Підраховано, що ІРК становить 16-28% пацієнтів з ІМС, а загальна поширеність становить 4,5-9,5 на мільйон жителів, досягаючи 35 на мільйон у осіб старше 50 років 5,15,16, хоча ці цифри може бути недооцінена через неправильне діагностування ПМ у пацієнтів з ІРМ. Незважаючи на те, що мало популяційних досліджень, існуючі демонструють різну поширеність залежно від країн та етнічної приналежності, ситуація відображена в таблиці 1. Беручи до уваги ці різні дані про населення, мультицентрові дослідження з більшою кількістю пацієнтів будуть необхідними для кращого визначити епідеміологію ІКМ та визначити її зв’язок із генетичними та екологічними факторами.
Поширеність населення міозиту інклюзійного тіла
| Країна | Поширеність на мільйон жителів | Довідково |
| Туреччина | 0,67 | Oflazer 2011 18 |
| Нідерланди | 4.9 | Badrising 2000 19 |
| нас | 7.06 | Вільсон 2008 20 |
| Японія | 9,83 | Suzuki 2011 21 |
| Західна Австралія | 14.9 | Needham 2008 15 |
Докази генетичної сприйнятливості при MCI засновані на дослідженнях HLA та основного комплексу гістосумісності (CHM). Асоціація з HLA-DR3 є найсильнішою з асоціацій суб'єктів з HLA, яка присутня приблизно в 75% випадків, хоча вона варіюється залежно від різних етнічних груп. Також було доведено, що родовий гаплотип CHM 8.1 асоціюється з MCI у австралійців, голландців та кавказців із Сполучених Штатів 6, а також гаплотип 52,1 у японській мові 3 .
На сьогодні етіопатогенез ІКМ залишається незрозумілим, незважаючи на численні дослідження та гіпотези з цього приводу. Здається очевидним є те, що задіяно кілька механізмів, згрупованих у запальні аутоімунні, дегенеративні та мітохондріальні типи, генетично модульовані та, можливо, викликані стимулом, який може бути інфекційним, хоча порядок дії або переважання кожного з них збирається уточнити 19 .
Як і в ПМ, в ICM, пряма цитокіно опосередкована цитотоксичність (IL-1, IL-6, IL-10, TNF-α, INF-γ, STAT, TGF-β) та хемокіни (MCP -1, PIP-1α, IP-10) запальний, і переважно CD8 + Т-лімфоцитами, які інвадують м'язові волокна, які експресують антигени CHM-I 20,21, ICAM-I, CD45RO та індуцибельний костимулятор (ICOS) 22 на своїй поверхні, в основному викликаючи його некроз після вивільнення перфоринів, гранзиму А та гранулізину 23,24. Ця інвазія відбувається на ранніх стадіях захворювання, і його наявність більша, ніж м’язових волокон з позитивним конго-червоним матеріалом 25, що, внаслідок цього, припускає, що запальні явища передують дегенеративним. Крім того, спостерігається підвищена реакція шаперонів (особливо Grp78) ендоплазматичного ретикулума, що є результатом зміни клітинного гомеостазу 26-29, що стимулює вироблення ядерного фактора κβ, що, в свою чергу, також індукує вивільнення запальних цитокінів, експресія антигенів класу СНМ класу і продукція білка-попередника амілоїду та інших депо-білків 30, що призводить до вторинних дегенеративних явищ.
З іншого боку, протягом тривалого часу не брали участі В-клітин у патогенезі ІКМ 31,32, поки в дослідженнях з мікрочипами на біоптатах м’язів, опублікованих у 2002 р. 33, не вдалося продемонструвати горезвісну транскрипцію імуноглобулінів, дозволяючи подальше підтвердження їх участі, демонструючи секрецію імуноглобулінів та їх клональне розширення 34,35 .
Усі ці запальні механізми також вимагають підозри про існування нокси, можливо інфекційної, як початкового пускового механізму захворювання 28,36, що може підтверджуватися наявністю подібних гістологічних змін між ВЧМ та деяким вірусним міозитом 37,38 .
На відміну від раніше заявленого, деякі автори захищають патогенез ІКМ як надзвичайно дегенеративний. Це базується на виявленні за допомогою імуногістохімії в біоптатах м’язів множинних білків, пов’язаних з іншими відомими дегенеративними процесами, такими як амілоїд-бета-білок та його попередник, прионний білок, аполіпопротеїн, анти-хемотрипсин 1, убиквітин тощо. 39–46. Після аномального вироблення та відкладення цих білків, особливо попередника бета-амілоїду, та подальшого його невдалого виведення відбувається прямий токсичний ефект, що призводить до ситуації стрес клітинного та ендоплазматичного ретикулуму, і це, таким чином, провокує вторинна запальна реакція 43. Основним слабким місцем цієї надзвичайно дегенеративної теорії є виявлення цих відкладних білків також при інших запальних міопатіях, таких як СД та ПМ, іноді у більшій кількості, ніж у MCI 33,45 .
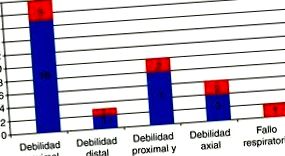
Форма представлення міозиту тіла включення у 36 пацієнтів, яким діагностували в лікарні Clínic de Barcelona протягом 10 років (червоним - випадки, які також мали дисфагію) 58 .
- Міозит як форма презентації; n від панартеріїту нодоза Клінічна ревматологія
- Здорова втрата ваги також може знизити ризик розвитку раку - Consumer Health News
- 3 тіла, які у вас є фізичні, емоційні та розумові - Марія Михайлова
- Худнути здоровим способом; БІОФАРМАЦІЯ SC
- Практикуйте Фронтеніс удвох, щоб підтримувати фізичну форму до і після весілля