Рак ендометрія - це рак, який виникає з ендометрію, який є оболонкою матки або матки. Це результат ненормального росту клітин, які мають здатність вторгуватися або поширюватися в інші частини тіла.
Рак ендометрія виникає найчастіше після менопаузи. Близько 40% випадків пов'язані з ожирінням. Рак ендометрія також пов’язаний із надмірним впливом естрогену, високим кров’яним тиском та діабетом. Перша ознака - це найчастіше вагінальні кровотечі, не пов’язані з менструацією. Інші симптоми включають хворобливе сечовипускання, біль під час статевого акту або біль у тазу.
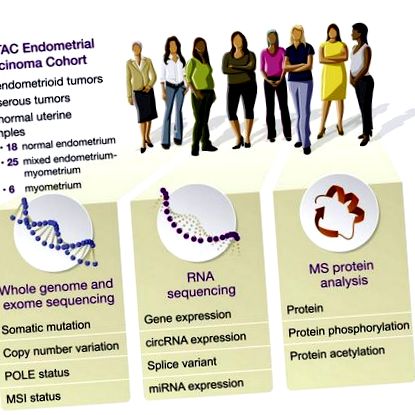
Велика група вчених, очолювана працівниками Медичної школи Нью-Йоркського університету (Нью-Йорк, Нью-Йорк, США), описала свою характеристику 95 перспективно зібраних карцином ендометрія, що включають 83 ендометріоїдні пухлини, 12 серозних пухлин і 49 нормальних тканин. Для свого дослідження дослідники провели секвенування цілого екзома, цілого генома та загального генома та секвенування мікроРНК на кожній пухлині та нормальній пробі разом з аналізом метилювання ДНК. Вони також кількісно визначили відносні рівні білків та сайти посттрансляційної модифікації (PTM) у зразках.
Пухлини класифікували на чотири геномні підтипи: POLE, рідкісний ультрамутований підтип з ендометріоїдною гістологією та хорошим прогнозом; мікросупутникова нестабільність (MSI), гіпермутований підтип ендометріоїда; низька кількість копій (CNV), становить більшість решти випадків ендометріоїдів; і CNV-високий, що включає всі серозні та більш агресивні ендометріоїдні раки. Когорта включала сім пухлин POLE, 25 MSI, 43 CNV-низьку та 20 CNV-високу. Рівні білка та РТМ відрізнялися між геномними підтипами.
Команда повідомила, що приблизно 61% всіх соматичних мутацій було виявлено у всіх семи пухлинах POLE, тоді як пухлини MSI містили 88% усіх інделів у когорті. Крім того, вони ідентифікували INPPL1, KMT2B та JAK1 як імовірно значно мутовані гени (SMG) у підтипі MSI. В іншому дослідженні команда проаналізувала мутації TP53 і виявила їх у 23 пухлинах у когорті, включаючи всі серозні карциноми. Замість того, щоб групувати всі TP53-мутовані пухлини та шукати єдиний молекулярний фенотип, вони розділяли їх за типом мутації та локалізацією та визначали різні протеомні та фосфопротеомічні ознаки.
Команда також порівняла протеомічні та транскриптомічні зміни між підтипами раку. Вони створили оцінку для кожного зразка на основі фосфопротеїнів маркера відповіді на пошкодження ДНК (DDR) і виявили, що зразки високого рівня DDR збагачені на серозні пухлини і, отже, високий підтип CNV, але ендометріоїдні пухлини з високим рівнем DDR походять з високогеномних підгруп, ПОЛЮС і MSI. Це вказувало на те, що активна сигналізація про пошкодження ДНК в основному не залежить від геномного підтипу.
Автори дійшли висновку, що інтеграція комплексних кількісних вимірювань білка, фосфорилювання та ацетилювання з геномними та транскриптомічними вимірами не тільки дала нові знання про фундаментальні біологічні процеси, пов'язані з канцерогенезом, але також запропонувала цікаві підказки щодо пошуку нових терапевтичних методів раку ендометрію., включаючи потенційні критерії вибору найбільш підходящих методів лікування. Дослідження було опубліковане 13 лютого 2020 року в журналі Cell.
- ХАРАКТЕРИСТИКА ДІЄТ - PDF Завантажити безкоштовно
- Антропометрична та рухова характеристика репрезентативної групи стрибків з полюсом
- Характеристика стовбурових клітин жирової тканини особин із ожирінням.
- Вони аналізують кризу на Кавказі в La Prensa Panama
- Carcinoma ex Pleomorphic Adenoma by Way of Case Insight Medical Publishing