Перегляньте статті та зміст, опубліковані в цьому носії, а також електронні зведення наукових журналів на момент публікації
Будьте в курсі завжди, завдяки попередженням та новинам
Доступ до ексклюзивних рекламних акцій на підписки, запуски та акредитовані курси
Слідкуй за нами на:
- Вступ
- Матеріали і методи
- Результати
- Обговорення
- Вступ
- Матеріали і методи
- Приготування ebhg з або без bfgf
- Дослідні тварини
- Індукція експериментальної ааа
- Групи лікування
- Гістологічний аналіз
- Статистичний аналіз
- Результати
- Зміни дня у 5 групах
- Гістологічний аналіз
- Обговорення
- Бібліографія
Аневризма черевної аорти (ААА) - це поширене захворювання, що загрожує життю, що характеризується дисбалансом між руйнуванням та синтезом позаклітинного матриксу стінки аорти. Формування аневризми пов’язане з хронічним трансмуральним запаленням, виснаженням популяції гладком’язових клітин (SMC) та надмірною продукцією матриці металопротеїнази (MMP), що спричиняє аномальну деградацію еластину та колагену 1, два. Стандартним методом лікування ААА є хірургічна корекція шляхом встановлення судинних імплантатів, а також ендоваскулярне відновлення аневризми, і все з метою запобігання летальному розриву ААА. Однак досі не існує ефективного медичного лікування для стабілізації аневризматичної патології та запобігання подальшому розширенню або розриву.
У дослідженні, описаному тут, ми обробляли щурів експериментальним ААА, використовуючи губковий лист з желатиновим гідрогелем (EBHG) або EBHG з включеним bFGF, щоб дослідити вплив цих обробок на прогресування експериментального ААА.
Матеріали та методи Приготування EBHG з або без bFGF
Рекомбінантний bFGF людини з ізоелектричною точкою 9,6 постачав Kaken Pharmaceutical (Токіо, Японія). EBHG готували, як описано раніше 13. EBHG виготовляли зшиванням кислотного желатину з ізоелектричною точкою 4,9. Його відливали в лист (15 х 7 х 2 мм) і ліофілізували. Перед розміщенням EBHG на аорті ліофілізований EBHG замочували водним розчином з bFGF або без нього протягом 1 години для отримання EBHG з bFGF або без нього, відповідно. Цей желатиновий губковий лист був розроблений для розкладання за 2 тижні.
Дослідні тварини
Самців щурів Sprague-Dawley (250-400 г) отримували з CLEA (Токіо, Японія) і використовували для експериментів. Це дослідження було дозволено Комітетом з догляду за тваринами Медичної школи університету Тохоку. Догляд за тваринами відповідав положенням Керівництва з догляду та використання лабораторних тварин (Національна дослідницька рада, Вашингтон, округ Колумбія, 1996).
Індукція експериментального ААА
Щурів знеболювали шляхом внутрішньовенного введення. пентобарбіталу натрію (50-60 мг/кг маси тіла: Dainippon Pharmaceutical, Осака, Японія), а також лапаротомію середньої лінії проводили в стерильних умовах. Виділено 1-сантиметровий сегмент інфраренальної аорти та перев’язано всі поперекові артерії. Зовнішній діаметр аорти вимірювали перед інфузією еластази (попередня інфузія DA) за допомогою цифрового штангенциркуля (Мітутойо, Канагава, Японія). Поліетиленовий катетер (Becton Dickinson, Sparks, MD) вводили в праву зовнішню клубову артерію і просували до ізольованої аорти. В проксимальну аорту був поміщений атравматичний затискач, а над дистальною аортою було зроблено тимчасову перев’язку для фіксації зонда. Ізольованій аорті вливали 2,7 одиниці свинячої підшлункової еластази типу I (E-1250, партія 84K7700; Sigma, Сент-Луїс, Міссурі) протягом 60 хв за допомогою ін’єкційного насоса (TOP-5200; TOP, Токіо, Японія). Після вливання еластази перев’язку та зонд видаляли, перев’язуючи праву зовнішню клубову артерію. Зачеревина і черевна стінка були закриті. Щурів переглядали на 14 день після втручання (14 DPI) і вимірювали максимум DA.
Групи лікування
Експериментальних щурів з інфузією еластази було випадковим чином розділено на 5 груп відповідно до обробок: група без лікування (необроблена група, n = 10), група, оброблена EBHG з включеною дистильованою водою (група EBHG, n = 10), 3 групи з EBHG з різними включеними кількостями bFGF (група EBHG + 100 нг, група EBHG + 1 мкг та група EBHG + 10 мкг; n = 10, 6 та 6 відповідно). Ці EBHG були розміщені над введеними еластазою аортами щурів, а заочеревина була закрита.
Проведено гістологічну оцінку 3 груп щурів, включаючи необроблену групу, групу з лише EBHG та групу з EBHG '100 нг (n = 6 відповідно). Щурів забивали на 14 день після втручання; 4% розчин параформальдегіду у сольовому розчині, забуференному фосфатом (PBS), перфузували протягом 5 хв через лівий шлуночок, а видалені аорти знову фіксували 4% розчином параформальдегіду в PBS протягом 2 годин з подальшим 100% етанолом. Зразки вбудовували в парафін та отримували гістологічні зрізи 5 мкм, які фарбували фарбою Верхоффа-ван Гісона (VVG) для еластичних волокон і готували до їх імуногістохімічного дослідження. Співвідношення забарвлених еластичних волокон/площа середнього значення при фарбуванні VVG розраховували за допомогою програмного забезпечення Image-J (NIH, Bethesda, MD).
Імуногістохімічне дослідження проводили після депарафінізації та регідратації. Зрізи обробляли протягом 10 хв H 2 O 2, щоб блокувати активність ендогенної пероксидази. Після блокування 1% бичачого сироваткового альбуміну в PBS протягом 30 хв гістологічні зрізи інкубували з первинним антитілом протягом ночі при 4 ° C, включаючи мишаче моноклональне антитіло до α-гладком'язового актину людини (α -SMA) людини (Sigma) для фарбування ХМЛ щурів та антитіл кролика до bFGF щурів (Санта Круз Біотехнологія, Санта Круз, Каліфорнія). Згодом інкубацію проводили з біотинільованими вторинними антитілами та комплексом авідин-біотин (Dako Cytomation, Glostrup, Данія) згідно з протоколом виробника. Гістологічні зрізи були забарвлені гематоксиліном. Експерименти з негативним контролем проводили шляхом заміни первинного антитіла неспецифічним мишачим або кролячим імуноглобуліном G. Медіальну щільність ХМЛ визначали шляхом усереднення α-SMA-позитивних клітин у 8 потужних полях, вибраних з 2 гістологічних зрізів.
Дані представлені як середнє значення ± стандартна помилка (SE). Результати оцінювались за допомогою одностороннього або двостороннього дисперсійного аналізу (ANOVA) із статистичною значимістю, призначеною для пост-специфіки Шеффе для порівняння окремих груп. Статистичний аналіз проводили з використанням програмного забезпечення StatView J-5.0 (SAS Institute, Cary, NC).
Результати змін LAD у 5 групах
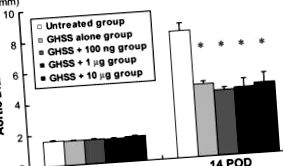
Зміни DA в 5 групах щурів з експериментальним AAA, індукованим інфузією еластази, представлені на малюнку 1. Доінфузійні DA були досить подібними між 5 групами. Інфузія еластази протягом 60 хв помітно збільшувала DA при 14 DPI у необробленій групі з 1,66 ± 0,02 до 8,16 ± 0,50 мм. За однакових умов у всіх групах лікування (тільки EBHG, EBHG + 100 нг, EBHG + 1 мкг та EBHG + 10 мкг) спостерігалося значно нижчий DA при 14 DPI (4,66 ± 0,20, 4, 19 ± 0,15, 4,30 ± 0,54, і 4,52 ± 0,64 мм відповідно), ніж у необробленої групи. Суттєвих відмінностей у DA не спостерігалося між групою, яка отримувала лише ГАМК, та 3 групами, які отримували ГАББ плюс bFGF.
Зміни AD в кожній групі. Попередня інфузія, перед інфузією еластази. Дані представлені як середнє значення ± SE n = 10 у групах, що не отримували лікування, EBHG та EBHG + 100 ng; n = 6 у групах EBHG + 1 мкг та EBHG + 10 мкг. * p Гістологічний аналіз
Ми дослідили наявність α-SMA в еластичних волокнах та ХМЛ у середньому шарі за допомогою фарбування VVG та імунозабарвлення відповідно. Фарбування VVG виявило помітне зменшення забарвлених еластичних волокон в середньому для необробленої групи (рис. 2а та 2b). Навпаки, фарбування еластичного волокна добре зберігалося в групах EBHG та EBHG + 100 нг (рис. 2c - 2f). Співвідношення між площею забарвлених еластичних волокон та площею середнього значення, розраховане за допомогою цифрового комп’ютеризованого зображення, було значно вищим у EBHG (23,8 ± 2,6%) та EBHG + 100 нг (24,8 ± 2,2%) ніж у необробленої групи (16,8 ± 0,9%), хоча суттєвих відмінностей у співвідношенні між групою EBHG та EBHG + 100 нг не спостерігалось (рис. 3). Кількість ХМЛ, забарвлених антитілами до α-SMA, в середньому була значно вищою в групах EBHG (81,8 ± 3,6/hpf) та EBHG + 100 нг (86,1 ± 2,2/hpf), ніж у групі, що не отримувала лікування (67,6 ± 3,2/hpf ), хоча суттєвих відмінностей у кількості ХМЛ між групами EBHG та EBHG + 100 нг не було (рис. 4 та 5).
Мікрофотографії стінки аорти з фарбуванням VVG для еластичних волокон. Еластичні волокна пофарбовані в чорний колір. Неліковані групи (a, b), лише EBHG (c, d) та EBHG + 100 нг (e, f). Н.е.: адвентиція; GHSS + 100 нг: біорозкладана губка з желатиновим гідрогелем (EBHG) + 10 нг; Поодинці GHSS: лише EBHG; М: середнє; Без лікування: без лікування. Оригінальне збільшення x100 (зображення ліворуч) і x400 (зображення праворуч).
Співвідношення еластичних волокон/площі середнього значення при фарбуванні VVG розраховували за допомогою програмного забезпечення NIH Image-J. Результати представлені як середнє значення ± SE для кожної групи. n = 6 у всіх групах. * p (a), лише EBHG (b) та EBHG + 100 нг (c). Н.е.: адвентиція; GHSS + 100 нг: біорозкладана губка з желатиновим гідрогелем (EBHG) + 100 нг; Тільки GHSS: лише EBHG; М: середнє; Без лікування: без лікування. Оригінальне збільшення x400.
Мікрофотографії стінки аорти з імунозабарвленням ХМЛ анти-α-SMA. Цитоплазма ХМЛ у середовищі забарвлена в коричневий колір. Неліковані групи (a), лише EBHG (b) та EBHG + 100 нг (c). Н.е.: адвентиція; GHSS + 100 нг: біорозкладана губка з желатиновим гідрогелем (EBHG) + 100 нг; Тільки GHSS: лише EBHG; М: середнє; Без лікування: без лікування. Оригінальне збільшення x400.
Щільність медіального ХМЛ визначали відповідно до кількості клітин, позитивних на α-SMA, у 8 потужних полях, вибраних у двох гістологічних зрізах. Результати представлені як середнє значення ± SE. N = 6 у кожній групі. * p (a), лише EBHG (b) та EBHG + 100 нг (c). Н.е.: адвентиція; GHSS + 100 нг: біологічно розкладається губчаста група з желатиновим гідрогелем (EBHG) + 100 нг; Тільки GHSS: лише EBHG; М: середнє; Без лікування: без лікування. Ці результати виявляють збільшення bFGF-позитивних клітин (цитоплазми та ядра) у середовищах та адвентиції лише EBHG та груп EBHG + 100 нг порівняно з необробленою групою. Оригінальне збільшення x200.
Мікрофотографії стінки аорти, імунозабарвлені антитілом проти bFGF. Неліковані групи (a), лише EBHG (b) та EBHG + 100 нг (c). Н.е.: адвентиція; GHSS + 100 нг: біологічно розкладається губчаста група з желатиновим гідрогелем (EBHG) + 100 нг; Тільки GHSS: лише EBHG; М: середнє; Без лікування: без лікування. Ці результати виявляють збільшення bFGF-позитивних клітин (цитоплазми та ядра) у середовищах та адвентиції лише EBHG та груп EBHG + 100 нг порівняно з необробленою групою. Оригінальне збільшення x200.
Це дослідження спочатку було розроблено для дослідження терапевтичних ефектів EBHG з включеним bFGF на прогресування експериментальної ААА за допомогою мишачої моделі ААА. EBHG використовували для підтримки місцевих та довгострокових ефектів bFGF. Ми підготували дві групи щурів з AAA, які діяли як контролі, включаючи групу без будь-якої обробки та іншу, оброблену EBHG без включеного bFGF, оскільки вплив EBHG на експериментальний AAA не був ясним. У той час як AD при 14 DPI у щурів EBHG 'bFGF було значно нижчим, ніж у необроблених щурів, лише у EBHG щури мали майже однакову AD при 14 DPI в порівнянні з щурами EBHG + bFGF. Наші результати також продемонстрували дозозалежний ефект bFGF. Ці результати свідчать про те, що розміщення EBHG на аорті має значний терапевтичний ефект на прогресування ААА, тоді як додатковий терапевтичний ефект bFGF був досить обмеженим.
Індукцію експериментальної ААА шляхом інфузії еластази спочатку виконували Аніджар та співавт., Які повідомили, що патологічні результати цієї моделі були подібними до результатів людської ААА. У цьому дослідженні ми оцінили еластичні волокна та середнє значення ХМЛ, які різко знижуються в ААА людини та експериментальних ААА 1,17. Наші результати продемонстрували помітне зниження еластичних волокон та ХМЛ у необроблених щурів, як це було описано в попередніх дослідженнях, тоді як щури, оброблені лише EBHG, значно послабили це зменшення еластичних волокон та ХМЛ. Лікування EBHG + bFGF також пом'якшило це зменшення, але статистичної різниці між щурами EBHG та щурами EBHG + bFGF не спостерігалося. Ці результати свідчать про те, що EBHG сам по собі покращує аневризматичну стінку, зберігаючи еластичні волокна та SMC, що призводить до зниження AD.
Додавання bFGF мало терапевтичного ефекту в цьому дослідженні. Крім того, не спостерігалось дозозалежного ефекту bFGF на прогресування експериментальної ААА. Хоча відомо, що bFGF сприяє проліферації різних мезенхімальних клітин, кілька досліджень повідомляють, що надмірна доза bFGF інгібує їх проліферацію і що його ефективність не залежить від дози 20,21. Отже, наші результати свідчать про те, що EBHG сам по собі індукує достатню кількість bFGF, щоб інгібувати прогресування експериментального AAA, і це, мабуть, причина відсутності додаткового ефекту після введення bFGF.
Терапевтичне значення желатинового гідрогелю з включеним bFGF широко досліджено експериментальним способом, пов'язаним з ангіогенезом 22, а також регенерацією кісток або шкіри 15,23, ініціюючи деякі клінічні застосування 24. Для того, щоб мати можливість застосовувати лікування за допомогою EBHG у людини ААА, необхідні методологічні вдосконалення, які дозволяють вводити його менш інвазивним способом, таким як мінілапаротомія або лапароскопічні методи. Оскільки в даний час важко виділити всю черевну аорту та обернути її EBHG у людей, у цьому дослідженні ми розмістили EBHG над черевною аортою, не обгортаючи її. Насправді розміщення EBHG над аортою викликало достатній ефект. Отже, це дослідження припускає, що достатньо застосовувати EBHG на передньобоковій стороні аорти як лікування ААА. Крім того, желатиновий гідрогель може бути у формі мікросфер 24,25 і може вводитися навколо ААА. Якщо можна застосувати малоінвазивний метод, це лікування можна застосовувати при малих ААА або у тих пацієнтів з аневризматичною патологією, які мають високий ризик хірургічного втручання.
Таким чином, наше дослідження чітко демонструє терапевтичні ефекти EBHG на прогресування експериментальної ААА. Лікування EBHG індукувало ендогенне вироблення bFGF, що збільшувало ХМЛ та фібробласти, зберігаючи деградацію еластичного волокна. Поліпшення результатів гістологічних результатів призвело до гальмування прогресування експериментальної ААА. Наші результати свідчать про можливе клінічне застосування біологічно розкладається EBHG для лікування ААА людини за допомогою малоінвазивного методу.
Ми вдячні доктору Шоджіро Мацуді, Gunze Limited Research and Development Center, за постачання EBHG та Kaken Pharmaceutical за постачання bFGF. Ця робота була підтримана грантом з наукових досліджень (JSPS-18591402) від Японського товариства сприяння науці.