Rev Chil Pediatr 2007; 78 (2): 169-175
Клінічний випадок
СПРАВА СПРАВИ
Повторний гострий панкреатит, клінічний випадок
Повторний гострий панкреатит
ПАМЕЛА АРГОЛЛО М. 1 , КРИСТІЙСЬКА ГАРЧА Б. два , ПОЛ Р. ГАРРІС Д. 3
1. Резидент педіатрії, Університет Понтіфії, Католіцький Чилі. Кафедра педіатрії. Медичний факультет, Понтифіція
Католицький університет Чилі.
два. Кафедра педіатрії та рентгенології. Медичний факультет, Понтіфійський університет католицького де Чилі.
3. Педіатричні відділення. Медичний факультет, Понтіфійський університет католицького де Чилі.
Передумови: Повторний гострий панкреатит (RAP) визначається як епізоди гострого панкреатиту з повним клінічним та анатомічним дозволом між кожними епізодами. Етіологія у дітей різноманітна (20-35% невідомо). Об’єктивна: Проаналізуйте етіологію, діагностику та найбільш відповідний скринінг RAP у дітей. Справа-звіт: 9-річний хлопчик із 6 епізодами гострого панкреатиту (АП); 4 з них потребували госпіталізації. Дослідження включало нормальну холангіопанкреатографію, нормальні основні імунологічні та метаболічні обстеження та негативну генетичну оцінку найпоширенішої мутації муковісцидозу. Під час епізодів AP були отримані 3 зображення комп’ютерної томографії, які показали AP в різному ступені (Baltasar C і E). Генетичне тестування на спадковий панкреатит було негативним. Проведена лапароскопічна холецистектомія. Висновок: RAP необхідно підозрювати у дітей з періодичними болями в животі та підвищеною концентрацією амілази-ліпази в сироватці крові, щоб розпочати адекватну оцінку.
(Ключові слова: рецидивуючий панкреатит, жовчний літіаз, спадковий панкреатит).
(Ключові слова: повторний панкреатит, камені в жовчному міхурі, спадковий панкреатит).
Вступ
Рецидивуючий гострий панкреатит (RAP) визначається як періодичні епізоди АП з повним клінічним дозволом між знімками та з повним відновленням паренхіми підшлункової залози. Повторні епізоди АП можуть призвести до хронічного панкреатиту з наслідками структурного пошкодження та пов'язаним з цим фактором ризику аденокарциноми підшлункової залози 4, 6 .
Метою даної роботи було обговорення етіологічного діагнозу ПАР у педіатрії та найбільш підходящого дослідження, для якого ми представляємо випадок дитини з ПАР.
Клінічний випадок
9-річний 8-місячний хлопчик з ожирінням в анамнезі (ІПТ: 139%, ІМТ: 23,5) та 6 епізодами АТ, з яких 2 лікувались амбулаторно. Перший епізод у віці 6 років. Щодо перших 3 епізодів ПАР було розпочато етіологічне дослідження, в якому виділились: УЗД черевної порожнини (УЗД) із жовчним міхуром без літіазу, нерозширена внутрішньо- та позапечінкова жовчна протока, магнітно-резонансна холангіопанкреатографія (МРХП) без патологічних висновки, жовч шляхом дуоденального звучання негативно для кристалів холестерину або мікролітіазу холестерину, але показує гранули білірубінату кальцію, які можуть бути пов'язані з пігментними каменями в жовчній протоці.
У пацієнта зі стабільними клінічними умовами етіологічне дослідження завершили імунологічною оцінкою, яка була нормальною (анти-ДНК, ANCA, ревматоїдний фактор, антинуклеарні антитіла та сироваткові імуноглобуліни). Крім того, було подано запит на тест на піт, який був нормальним (32 мекв NaCl), і дослідження мутації на муковісцидоз, яке не виявило жодної мутації протягом 29 досліджених мутацій. Його виписують у загальному загальному стані, безсимптомно та з останнім контролем ліпази при 104 ОД/л.
Через анамнез ПАР, відсутність ідентифікованої етіології та врахування ризиків було вирішено виконати планову холецистектомію, яку виконують лапароскопічно через 45 днів після 4-го епізоду АП, виявивши розтягнутий жовчний міхур без літіазу, гістологічне дослідження якого ззаду було нормальним.
Через два місяці після профілактичної холецистектомії вона представила новий епізод неспецифічного болю в животі, розташованого в епігастрії, без опромінення, а згодом жовчної блювоти та водянистої діареї без патологічних елементів. Ферменти його підшлункової залози виявлені підвищеними (амілаза: 230 ОД/л і ліпаза: 496 ОД/І), з-за чого було прийнято рішення про його госпіталізацію, яка розвивалася задовільно, зі зменшенням болю, без нових епізодів блювоти. Отримавши стабільну концентрацію ліпази в сироватці крові 145 ОД/л, його виписали з лікуванням на основі ферментів підшлункової залози (Creon®), намагаючись зменшити секрецію підшлункової залози за допомогою негативного зворотного зв’язку шляхом зниження секреції секретину/CCK до рівня дванадцятипалої кишки.
Після його п’ятого епізоду та безсимптомного втручання було проведено MRCP, який не продемонстрував анатомічних змін жовчної протоки або проток підшлункової залози, особливо відсутні дані про поділ підшлункової залози (рис. 2).
Одночасно в рамках спадкового дослідження PAR та за відсутності сімейної історії PAR проводили аналіз генетичних мутацій генів катіонного трипсиногену (PRSS1) та інгібітора трипсину підшлункової залози (SPINK1), виявляючи мутацію в екзоні 2 PRSS1, незвична знахідка без чіткого клінічного кореляту. Дослідження батьківських мутацій було нормальним (доктор Фолькер Кім, Університетська клініка Лейпцига, Німеччина).
Через два місяці дитина представила новий епізод PAR, що складається з дифузного гнітючого болю в животі, пов’язаного з жовчою блювотою, для чого він звернувся до відділення невідкладної допомоги, було досліджено підвищення рівня ферментів підшлункової залози з ліпазою в 3545 МО/мл та амілазою в 3720 МО/мл і був госпіталізований. Він поступив у гемодинамічно стабільний стан, починаючи годування з назоєюнальної трубки, добре переноситься. Під час прийому була зроблена контрольна КТ живота, яка показала збільшення об’єму підшлункової залози, без ознак некрозу та рідини в регулярній кількості перипанкреатичної та лівої периренальної, сумісної з Baltasar D. Контрольна КТ черевної порожнини із відвертим поліпшенням запальних ознак, з дозволом колекцій та зменшенням обсягу підшлункової залози, без ділянок, що свідчать про некроз. Він еволюціонував стабільно, зі зниженням рівня ліпази в сироватці крові та з прогресивним пероральним перегодовуванням.
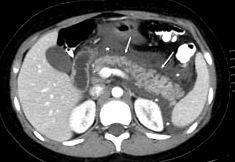
Рисунок 1. КТ черевної порожнини на осьовому зрізі із застосуванням перорального та внутрішньовенного контрастного речовини показує дифузне збільшення розміру, неправильність та зміну структури підшлункової залози (стрілки), пов’язане зі збільшенням щільності жирової тканини навколошлункової залози (*) та рідких колекцій (*), без ділянок некрозу підшлункової залози.
Малюнок 2. MRCP показує жовчні протоки та протоки підшлункової залози без явних морфологічних змін. HCC: загальний печінковий проток; С: загальна жовчна протока; ПК: головний підшлунковий проток (Wirsung); D: дванадцятипала кишка.
Обговорення
PAR є ще рідшим об'єктом, ніж AP, і його причини відрізняються на 1 - 3. Етіологія АП у дітей різноманітна. Травма живота є найчастішою причиною АП за різними серіями (20-33%), а потім ідіопатична етіологія (20-35%), жовчнокам'яна хвороба та наркотики. Інфекційні причини (CMV, коксакі В, вітрянка, Salmonella typhi, Campylobacter та ін.), Вроджені причини, причини, вторинні до інвазивних процедур сосочка (ERCP), а метаболічні причини рідше зустрічаються 4, 5, 7. У педіатрії важливо виділити муковісцидоз, синдром Рейє та вроджені структурні аномалії (підшлункова залоза) у дослідженні дитини з АР 1 - 3 .
Повторний гострий панкреатит (RAP) визначається як епізоди гострого панкреатиту з повним клінічним дозволом між знімками та з повним відновленням паренхіми підшлункової залози. PAR можна розділити на 5 категорій, які визначають остаточний діагноз. Це: медикаментозне захворювання, гіпертригліцеридемія, приховані захворювання жовчі або підшлункової залози, сімейний (спадковий) панкреатит та ідіопатичний.
Хоча багато ліків можуть викликати панкреатит (близько 100), насправді доведено, що мало хто викликає панкреатит у людей. Це азатіоприн та 6-меркаптопурин, сульфаніламіди, тіазиди, фуросемід, естрогени, внутрішньовенний тетрациклін, вальпроєва кислота та пентамідин. У більшості випадків розвиток ПА не залежить від дози. Основним ускладненням АП щодо вживання наркотиків є утворення псевдокіст підшлункової залози (ПП) 3, 8, 15 .
Гіпертригліцеридемія - одна з причин ПАР, яка часто недостатньо досліджена. Пацієнти з PAR мають високий рівень тригліцеридів у крові з рівнем> 500 мг/дл, який може навіть перевищувати 3800 мг/дл.
З іншого боку, всіх пацієнтів з RAP слід обстежувати за допомогою ERCP або MRCP, у пошуках прихованих захворювань жовчних та підшлункових проток, найчастішою причиною є наявність жовчнокам’яної хвороби, а потім розділення підшлункової залози та дискінезія жовчних шляхів.
Сімейний або спадковий панкреатит (РН) може проявлятися як будь-який тип панкреатиту і може спричинити всі ускладнення алкогольного панкреатиту8. Це аутосомно-домінантне захворювання, типові клінічні прояви якого включають періодичні епізоди АП, які неможливо відрізнити від іншої етіології АП, які зазвичай починаються в дитячому віці і можуть перерости у хронічний панкреатит (ХП) та/або рак підшлункової залози. У 60-80% випадків спостерігається мутація катіонного гена трипсиногену (R122H, N29I), однак причинно-наслідковий зв'язок для багатьох мутацій, які перебувають під активною ідентифікацією, не встановлений 12, 13 .
Нарешті, ідіопатичний панкреатит зустрічається приблизно у 20-35% пацієнтів з ПАР без ідентифікованої причини; однак у багатьох із цих дітей може бути мікролітіаз або невідомі мутації. 8, 15 .
За останні роки було виявлено багато генетичних факторів ризику ХП, причому наявність мутацій катіонного трипсиногену (N29I та R122H) є найвищим ризиком. Мутації інгібітора сироваткової протеази (важливого інгібітора трипсину підшлункової залози) були пов'язані з ідіопатичним ХП та алкогольним ХП 13, 14 .
У рамках візуалізаційного дослідження УЗД може бути корисним для первинної оцінки цих пацієнтів, хоча це може бути нормальним явищем у випадках ГП. Незважаючи на те, що він може продемонструвати збільшення розмірів підшлункової залози та зміну її внутрішньої структури, його найкращі показники виявляються та контролюються збір рідини, псевдокісти 3, 6. КТ черевної порожнини та тазу дозволяє чудово анатомічно демонструвати роботу підшлункової залози і може показати легке запалення підшлункової залози навіть без підвищення рівня ферментів підшлункової залози. Оскільки в деяких випадках RAP є вторинним щодо окультних каменів у жовчному міхурі, пропонується провести дослідження жовчі або дванадцятипалої кишки в пошуках мікрокристалів або неодноразово проводити візуалізацію, як це було у нашого пацієнта.
Клінічні критерії Ренсона та критерії візуалізації Бальтасара були використані при прогностичній оцінці АП, які підтверджуються у дорослих. В даний час додано так званий індекс тяжкості Бальтасара, який спільно оцінює ступінь запалення підшлункової залози та відсоток залозистого некрозу, які також були оцінені в Чилі 9 .
Найважливішим ускладненням PAR є шок, який виникає протягом перших 24-48 годин після початку стану і може призвести до смерті пацієнта, якщо не проводити своєчасне та адекватне лікування. Серед інших ускладнень виділяються гіпокальціємія, жовтяниця, легеневі ускладнення (ателектаз, плевральний випіт), ниркова недостатність, сепсис, некроз підшлункової залози, абсцеси та РР 1, 6. .
В рамках природної історії ідіопатичної PAR може розвинутися хронічний панкреатит або рак підшлункової залози, що є четвертою причиною смерті в США серед дорослих. Близько 90% пацієнтів діагностуються на неоперабельних стадіях, що підкреслює важливість етіологічного дослідження ПАР, включаючи раннє генетичне дослідження.
Хронічний панкреатит характеризується наявністю кальцифікатів, розширенням проток підшлункової залози або типовою гістологією ХП. Прогресування генетично обумовленого ХП відбувається у 3 фази: початкова фаза із симптомами, що вимагають госпіталізації; проміжна фаза з підвищеним ризиком розвитку кальцифікацій підшлункової залози, розширення протоки та необхідності хірургічного втручання; і пізня фаза з розвитком діабету. Це важливо, щоб мати можливість диференціювати його від прогресування алкогольного ХП, який має більш швидке прогресування і є основною причиною ХП у дорослих 16 .
Лікування ПА буде залежати від ступеня тяжкості. При слабкому АТ потрібен лише відпочинок, голодування, внутрішньовенна гідратація, заміщення електролітів та знеболення. Аспірація через назогастральний зонд може бути корисною для зменшення симптомів, але це не скорочує час хвороби. При середньотяжкому та тяжкому перебігу АТ необхідне лікування інтенсивної терапії для адекватної реанімації у разі гіповолемічного шоку, ниркової недостатності та дихальної недостатності. .
Пацієнти з АП мають метаболізм, подібний до того, що має сепсис, оскільки існує гіперметаболічний стан, який потребуватиме адекватної харчової підтримки. Сучасна рекомендація для пацієнтів, які не отримували їжу більше 7-10 днів і не страждають на ілеус, полягає в тому, щоб розпочати ентеральне харчування через назоєюнальну трубку (дистально від кута Трейца), яку слід періодично контролювати рентгенологічно для виявлення можлива міграція. Повне парентеральне харчування призначене для пацієнтів, які потребують агресивного вживання їжі, у яких не забезпечений адекватний ентеральний доступ або які несприятливо прогресують при ентеральному харчуванні. Пероральне годування буде відновлено відповідно до таких критеріїв: відсутність болю в животі, зниження рівня амілази та ліпази в сироватці до рівнів, близьких до норми, відсутність ускладнень та розрідження клубової кишки з поверненням шумів повітряно-рідинної рідини 2 .
Список літератури
Стаття надійшла 5 січня 2007 року, прийнята до друку 29 березня 2007 року.
Весь вміст цього журналу, крім випадків, коли він ідентифікований, підпадає під ліцензію Creative Commons
Мер Едуардо Кастільо Веласко 1838
Сунюа, Сантьяго
Графа 593-11
- Повторний випадок гострого панкреатиту
- Важкий та ранній гострий панкреатит через ліраглутид
- Гострий панкреатит Revista de Gastroenterología de México
- Лапароскопічна плікація шлунка, нова баріатрична процедура щодо клінічного випадку
- Хронічний гнійний остеомієліт у звіті верхньої щелепи клінічного випадку