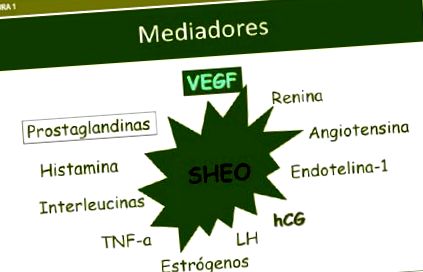
Синдром гіперстимуляції яєчників є ятрогенним ускладненням методів стимуляції яєчників. Етіологія його невідома, але він з’являється лише у присутності ХГЧ, що спричиняє вивільнення вазоактивних речовин: інтерлейкінів, IGf-1, активації ренін-ангіотензин-альдостеронової системи, простагландинів та VEGF, який, здається, є головним посередником . Переглянуто аспекти патофізіології синдрому, стратегії його профілактики та сучасні рекомендації щодо лікування.
Синдром гіперстимуляції яєчників (OHHS) є ятрогенним ускладненням індукції овуляції. Етіологія невідома. Пусковим фактором синдрому є ХГЧ, який спричинює продукцію ангіогенних речовин: інтерлейкінів, IGF-1, ренін-ангіотензинової системи та VEGF, головного медіатора. Розглянуто фізіопатологію, стратегії профілактики та лікування ЗГС.
ВСТУП
Синдром гіперстимуляції яєчників (OHSS) є ятрогенним ускладненням методів стимуляції яєчників. Частота розвитку синдрому коливається в межах 3-6% циклів ЕКО при помірних формах та 0,5-2% у важких випадках. Етіологія захворювання невідома, але відомо, що синдром з’являється лише у присутності ХГЧ. Хоча це не є причинним фактором, він є пусковим механізмом для медіаторів, які беруть участь у патофізіології.
ПАТОФІЗІОЛОГІЯ
OHSS розвивається після введення HCG, що спричиняє вивільнення яєчником вазоактивних речовин, які виконують функцію медіаторів: інтерлейкінів I та VI, IGF-1, системи ренін-ангіотензин-альдостерон, особливо ангіотензину II, простагандинів та медіаторів запалення, але VEGF визначено головним посередником. Ці фактори спричиняють збільшення проникності судин із витоком води та білків з внутрішньосудинного простору в третій простір, зменшуючи перфузію нирок, серця або мозку. Естрадіол підвищений, але не має прямого вазоактивного ефекту (рисунок 1).
Вазоактивні речовини, що виділяються яєчником у присутності ХГЧ, спричиняють збільшення проникності судин із витоком води та білків з внутрішньосудинного простору в третій простір. Це спричинює виснаження внутрішньосудинного об’єму, що відповідає за симптоми синдрому: гіпотонія, олігурія, асцит, підвищена в’язкість крові, гіпонатріємія та гіперкаліємія. Ця гіповолемія пов’язана з гемоконцентрацією, зниженням центрального венозного тиску, артеріальною гіпотензією та тахікардією.
Зниження ниркової перфузії призводить до посиленої реабсорбції натрію та води в проксимальних канальцях, що призводить до олігурії та низької концентрації натрію в сечі (рис.2).
Утворення нових судин має важливе значення для репродуктивного циклу, і роль факторів росту, що беруть участь у регулюванні цього процесу, зокрема VEGF, була продемонстрована змінами в їх експресії протягом циклу. Інтрафолікулярні рівні VEGF, особливо VEGF-A, зростають під час фолікулярної фази, з піком на початку лютеїнової фази. Подальша судинна регресія під час атрезії фолікулів зумовлена підвищеним рівнем інгібіторів ангіогенезу та зниженням рівня VEGF в кінці лютеїнової фази (рис. 3).
Клітини гранульози, теки фолікула, що розвивається, і стероїдогенні клітини жовтого тіла виробляють і реагують на ангіогенні фактори та вазоактивні пептиди. Неоваскуляризацію, що відбувається після овуляції, на ранніх стадіях розвитку жовтого тіла, порівнювали із швидким ангіогенезом, який спостерігається при зростанні пухлини.
У стимульованих циклах експресія VEGF та його рецептора 2 збільшується у відповідь на hCG, а при OHSS максимальні рівні збігаються з максимальним збільшенням судинної проникності.
Введення ХГЧ викликає надмірну експресію VEGF на рівні яєчників, ймовірно, через генетичну схильність. Після зв’язування VEGF з VEGFR2 відбувається активація рецепторів, що призводить до збільшення проникності судин, що спричиняє синдром. Оскільки перший етап активації VEGFR2 включає фосфорилювання рецепторів, можна вважати, що введення каберголіну блокує фосфорилювання VEGFR2 і, отже, ферментативний каскад, що призводить до збільшення судинної проникності, що характеризує синдром. Цей блок не впливає на рецептор VEGF 2, від якого залежить лютеїновий ангіогенез. Тобто він частково пригнічує фосфорилювання VEGF-R2 (1). Насправді, як повідомлялося, 0,25 мг на добу протягом 8 днів з дня введення ХГЧ зменшують частоту СГЯ та ННТ 9. У огляді Кокрана він зменшує ризик помірного, але не важкого СГС.
Додавання hCG в культуру ендотеліальних клітин здатне змусити їх секретувати VEGF, збільшити присутність рецепторів VEGF-рецептора 2 та підвищити проникність капілярів, продемонструвавши спостерігаючи поділ одношарових клітин при фарбуванні їх актинових ниток і спостерігаючи за ними конфокально мікроскопія. Найцікавішим у цих дослідженнях було те, що за допомогою антитіла проти VEGF цей ефект hCG на ендотелій був зворотним. Застосування селективного інгібітора рецепторів VEGF-2 пригнічує збільшення проникності капілярів у онкологічних пацієнтів in vivo: вже є клінічні випробування III фази, які демонструють це.
Ангіотензин II (Ang II) добре відомий своєю роллю в контролі ангіогенезу на системному рівні. Крім того, Ang II діє на судинний контроль на рівні яєчників, при утворенні жовтого тіла та лютеолізі. Ang I продукується з попередника, ангіотензиногена, ферментативною активністю реніну, який знаходиться в гранульозі, теках та лютеїнових клітинах. Клітини мікросудинного ендотелію мають фермент, що перетворює ангіотензин, і здатні перетворювати Ang I в Ang II (Рисунок 4).
Наявні дані свідчать про те, що Ang II може відігравати роль у розвитку початкового жовтого тіла. Було показано, що Ang II стимулює рівень мРНК для bFGF в лютеїнових клітинах і збільшує проліферацію ендотеліальних клітин аорти у великих рогатих худобах. Крім того, комбінація естрадіолу та VEGF або bFGF збільшує продукцію Ang II у лютеїнових ендотеліальних клітинах. Система ренін-ангіотензин активна протягом початкової лютеїнової фази, і в ній беруть участь ендотеліальні клітини (2) .
КЛАСИФІКАЦІЯ
Існують різні класифікації синдрому гіперстимуляції яєчників, одна з них - та, яку Навот модифікував у 1996 р. (Рис. 5 і 6), від класифікації, визначеної Голаном, яка розрізняє важку та критичну гіперстимуляцію (3). .
I клас - Легкий. Характеризується двостороннім збільшенням яєчників до 5x5 см з множинними фолікулами та жовтими тілами. Естрадіол перевищує 1500 пг/мл (6000 пмоль/л)
ІІ клас - Помірний. Яєчники більші, до 12 см, і пацієнтка відчуває біль у животі або дискомфорт та шлунково-кишкові симптоми (нудота, блювота та діарея). Раптовий приріст ваги понад 3 кг може бути ранньою ознакою помірного рівня СГЯ.
III ступінь - важкий. Яєчники розміром більше 12 см, ацит та порушення функції нирок. Це вважається критичним, коли спостерігаються плевральний та/або перикардіальний випіт, електролітні порушення (гіпонатріємія, гіперкаліємія), гіповолемія та гіповолемічний шок. Виражена гемоконцентрація, підвищена в'язкість крові, тромбоемболічні явища, включаючи дисеміновану внутрішньосудинну коагуляцію в найважчих випадках.
Регресія є спонтанною і настає через 10-14 днів після настання, але якщо вагітність настає, її вирішення займає більше часу.
СТРАТЕГІЇ ПРОФІЛАКТИКИ
Найкраще лікування - це первинна профілактика: не вводити ХГЧ (4). Їх можна розглянути на 3 рівнях:
1. Під час стимуляції
до. Стимуляція гонадотропіну в низьких дозах та ретельний контроль
b. Набережна. Хоча на сьогоднішній день було доведено, що воно є ефективним у ретроспективних та спостережних дослідженнях, недостатньо доказів, що рекомендують використовувати руйнування в рутинній практиці (Cochrane 2011 показав, що доказів користі немає). Коустінг ставиться під сумнів через його можливий вплив на кількість та якість ооцитів, нижчу сприйнятливість ендометрія по відношенню до падіння естрадіолу та рівень вагітності нижчий, ніж рівень звичайного лікування ЕКО.
c. Блок гіпофіза з антагоністами замість агоністів. Зменшує частоту, але не усуває її
d. Дозрівання ооцитів in vitro. Мало ефективна стратегія з точки зору репродуктивних результатів
2. В індукції овуляції
до. Скасуйте цикл і не вводьте ХГЧ. Це єдина ефективна стратегія сама по собі
b. Зменшіть дозу ХГЧ навпіл
c. Викликають овуляцію болюсом агоністів GnRH. Можливо лише тоді, коли антагоністи використовували для блокади гіпофіза
d. Існує припущення, що внутрішньовенне введення альбуміну або гідроксиетилкрохмалю під час пункції може бути використано як профілактичний засіб у жінок із високим ризиком. Точний спосіб дії альбуміну невідомий, але вважається, що він блокує вазоактивні речовини, що беруть участь у патогенезі СГЯ, а з іншого боку, він підвищує внутрішньосудинний онкотичний тиск, тим самим запобігаючи втраті води з внутрішньосудинного відділу. Існує безліч досліджень із суперечливими результатами. Cochrane 2011 показав, що немає жодних доказів вигоди.
і. Вводити каберголін 1 тиждень від ХГЧ. У дозі 0,25 мг/добу частота раннього легкого або помірного СГЯ зменшується, але не тяжкого або пізнього СГЯ. Не ефективно, якщо настає вагітність
3. Уникайте ендогенного та екзогенного ХГЧ
до. Не вводити ХГЧ в лютеїновій фазі
b. Не здійснюйте переказ. Вітрифікуйте ооцити або ембріони. Якщо ХГЧ не вводили, усуває ризик СГЯ.
Манчіні та ін. у 2011 р. вони провели мета-аналіз 5 досліджень, в яких вивчали 286 циклів з антагоністами проти 303 з агоністами і дійшли висновку, що у пацієнтів із синдромом мікрополікістозних яєчників (СПКЯ) протокол антагоністів зменшує частоту СГЯ (5). Пундір Дж та інші в 2012 році дійшли такого ж висновку (6) .
Крім того, сьогодні ми знаємо, що цикл, розпочатий антагоністами, дозволяє замінити дозрівання ооцитів HCG болюсом агоністів GnRH, і це повністю дозволяє уникнути синдрому (якщо в цьому циклі немає вагітності), як запропоновано Гризінгером в 2011 році (7 ). Humaidan P пояснює, що, хоча індукція дозрівання ооцитів α-GnRH є хорошою альтернативою уникненню СГЯ, лютеїнова фаза недостатня і пов'язана з низькими показниками імплантації.
Кріоконсервація ембріонів - це метод профілактики СГЗ, який намагається уникати вагітності як джерела ендогенного ХГЧ. Гарсія-Веласко у 2012 р. (8) та Гумадіан у 2014 р. (9) пропонують кріоконсервацію всіх ембріонів у пацієнтів з високими піками естрадіолу та вказують на кріотрансфер у наступних циклах з фізіологічним рівнем естрадіолу. Це також покращує перинатальні ускладнення, такі як прееклампсія або затримка внутрішньоутробного росту (IUGR). Ця стратегія дозволяє уникнути появи SHEO
Незважаючи на те, що застосування бромокриптину та каберголіну не асоціюється із підвищеною тератогенністю, найкраще обмежувати вплив ембріона на ці препарати, коли це можливо. Тератогенез будь-якого препарату або причини зазвичай відбувається протягом першого триместру вагітності. Перший триместр збігається з періодом мінімального зростання макроаденоми у вагітної, яка припинила лікування. Тому відміна бромокриптину або каберголіну рекомендується при пропуску першої менструації та отриманні позитивного тесту на вагітність. Особливо каберголін має дуже тривалу дію, і значення PRL можуть бути пригнічені до 120 днів після його відміни.
Дослідження розмноження кроликів не показали тератогенних та ембріотоксичних ефектів. Однак, оскільки немає контрольованих досліджень на вагітних, каберголін не слід застосовувати під час вагітності, якщо це не є абсолютно необхідним (10).
ЛІКУВАННЯ
СГЯ - це самообмежений процес, і за відсутності вагітності пацієнтка нормалізується з початком менструації. У разі вагітності симптоми можуть тривати протягом декількох тижнів. Лікування повинно бути симптоматичним та консервативним, відновлюючи внутрішньосудинний об’єм при застосуванні кристалоїдів та/або альбуміну, уникаючи можливих ускладнень, які можуть з’явитися. Зазвичай медичного лікування достатньо для більшості пацієнтів, і хірургічне лікування залишається за катастрофічними ускладненнями: перекрут яєчника або несамообмежена кровотеча. Пацієнтам з важкими симптомами може знадобитися лікування ВІТ.
Необхідно ретельно контролювати водний баланс, правильно реєструючи входи та виходи, щодня вимірювати вагу та окружність живота, а також гематокрит. Якщо пацієнт гемодинамічно нестабільний, слід встановити центральний катетер венозного тиску.
Загалом, протягом першої години слід давати 1-2 л ізотонічної рідини для швидкого відновлення перфузії тканин. Якщо вводиться більше рідини, слід контролювати центральний венозний або легеневий капілярний тиск. Поповнення рідини слід продовжувати, коли тиск наповнення серця та системний артеріальний тиск низькі. Розширювачі плазми, такі як декстран, альбумін людини або плазма, за необхідності повинні бути доповнені відповідними електролітами. Ефект від лікування може бути посилений додаванням перорального індометацину, який блокує синтез простагландинів та зменшує проникність капілярів. Слід контролювати гематокрит і припиняти розширювачі, коли гематокрит опускається нижче 38%.
Діуретики не рекомендуються, оскільки рідини третього простору це не впливає. Більше того, більшість діуретиків діють у дистальних канальцях, з мінімальним ефектом у проксимальних канальцях. Індукований лікарськими засобами діурез може зменшити внутрішньосудинний об’єм і не мати можливості очистити асцит або гідроторакс. Ниркова недостатність може реагувати на дофамін (0,18 мг/кг на годину). Пероральний докарпамін може бути можливим у пацієнтів із СГЯ, яким потрібен дофамін.
Небезпека пошкодження внутрішніх органів сліпим парацентезом зменшується за допомогою ультразвукового наведення. Парацентез забезпечує швидке поліпшення функції нирок (завдяки збільшенню венозного повернення), осмолярності та гемоконцентрації, а також полегшення задишки та дискомфорту в животі. Для зняття задишки плевральний випіт повинен бути дренований. Парацентез також може бути корисним для полегшення утруднення дихання у пацієнтів з асцитом та гідротораксом.
Слід розглянути можливість профілактичної антикоагуляції гепарином або НМГ та компресійними панчохами, щоб мінімізувати ризик венозного тромбозу. Лікування венозних ускладнень - це антикоагуляція гепарином.
Через кілька днів рідина з третього простору знову потрапляє у внутрішньосудинний простір, гемоконцентрація змінюється, а виділення сечі нормалізується. Пацієнт симптоматично покращується, і споживання рідини через рот відновлюється. Внутрішньовенні рідини слід зменшувати у міру збільшення внутрішнього прийому. Пероральний прийом слід обмежити 1-2 л, щоб полегшити діурез та підтримати об’єм крові. Повне вирішення проблеми зазвичай займає 10-14 днів з моменту появи симптомів (Рисунок 8).
У пацієнтів з важкою СГЯ спостерігається обмежувальна екстрапаренхімальна легенева дисфункція через скупчення внутрішньочеревної або плевральної рідини, що обмежує спуск діафрагми та розширення легенів. Це спричиняє некоординовану вентиляцію та ателектаз з порушеннями вентиляції та перфузії та гіпоксемією.
Клінічні прояви включають задишку, тахіпное, помірну гіпоксемію, збільшення альвеолярно-артеріальної різниці кисню, гіпокарбію, алкалоз дихання та завершення обміну речовин.
Тромбоемболічні ускладнення - найрідкісніші, хоча найсерйозніші з усіх випадків СГЯ. Опубліковано тромбоемболічні ускладнення внутрішніх яремних, підключичних, пахвових та брижових судин. Вони можуть спричинити постійне неврологічне пошкодження або смерть. Вони зумовлені гемоконцентрацією та гіперкоагуляцією, і більшість з них є наслідком високого рівня естрогенів
Пацієнти з генетичною тромбофілією (дефіцит антитромбіну III, мутація F. V, дефіцит білка С або S, більше схильні до розвитку тромбоемболічних явищ у ситуаціях ризику, тому деякі центри проводять скринінг на тромбофілії перед початком стимуляції яєчників.
Таким чином, важкий синдром гіперстимуляції яєчників є передбачуваним, запобіжним та уникнутим станом у більшості випадків. Незважаючи ні на що, жодна стратегія не є абсолютно ефективною. У випадках, коли це викликано, лікування повинно бути симптоматичним і часто мультидисциплінарним, приділяти увагу виправленню дисфункції гідричного балансу та попередженню його ускладнень, з мінімально можливими інвазивними заходами, і завжди враховуючи можливість вагітності за умови перенесення ембріона.
- Сесія 2 Загальний синдром (астенія, анемія, втрата ваги) з остеопенією та придушенням
- Vitex agnus-castus - одне з найкращих методів лікування с; Передменструальний синдром (ПМС) - Ферма
- Терапевтична; впливу s; апное уві сні та синдром гіпопное; o Інтегральна медицина
- Землетрус сколихнув Коста-Рику - Ла-Пренса
- S; ndrome; Інформаційний центр з питань генетичних та рідкісних захворювань (GARD) - програма NCATS